(Cánh diều) Lý thuyết KHTN 8 Bài 3: Biến đổi vật lý và biến đổi hóa học Định luật bảo toàn khối lượng, phương trình hóa học
Tóm tắt Lý thuyết Khoa học tự nhiên 8 Cánh Diều Bài 3. Định luật bảo toàn khối lượng, phương trình hóa học theo chương trình Sách mới ngắn gọn nhất. Tổng hợp lý thuyết Khoa học tự nhiên 8 trọn bộ chi tiết, đầy đủ.
Bài 3. Định luật bảo toàn khối lượng, phương trình hóa học
I. Định luật bảo toàn khối lượng
Thí nghiệm 1:
Dụng cụ: Cân điện tử, binh tam giác, ống hút nhỏ giọt, ống đựng
Hoá chất: Na2SO4, BaCl2
- Tiến hành:
Bước 1: Đặt bình tam giác trong đó có chứa 10 mL dung dịch BaCl2, trên đĩa cân điện tử và lấy đầy dung dịch Na2SO4 vào ống hút nhỏ giọt. Ghi chỉ số khối lượng hiện trên mặt cân (m1).
Bước 2: Bóp nút ống hút để dung dịch Na2SO4 chảy xuống bình. Quan sát dấu hiệu của phản ứng xảy ra. Ghi chỉ số khối lượng hiện trên mặt cân (m2).
So sánh m1 và m2, rút ra nhận xét về tổng khối lượng của các chất trước và sau phản ứng.
Phản ứng hoá học xảy ra ở thí nghiệm 1 có thể được biểu diễn bằng sơ đồ dạng chữ như sau:
Barium chloride + Sodium sulfate → Barium sulfate + Sodium chloride.
Tổng khối lượng của các chất tham gia phản ứng (barium chloride và sodium sulfate) = Tổng khối lượng của các chất sản phẩm (barium sulfate và sodium chloride).
=> Định luật: Trong một phản ứng hoá học, tổng khối lượng của các chất sản phẩm bằng tổng khốilượng của các chất tham gia phản ứng.
Giải thích: Trong phản ứng hoá học chỉ diễn ra sự thay đổi liên kết giữa các nguyên tử; số nguyên tử của mỗi nguyên tố trước và sau phản ứng không thay đổi, khối lượng nguyên tử không thay đổi. Vì vậy, tổng khối lượng của các chất được bảo toàn.
Thí nghiệm 2:
- Chuẩn bị: Dụng cụ: Cân điện tử, bình tam giác (loại 100 mL), ống đong.
Hoá chất: Bột sodium hydrogencarbonate (NaHCO3), dung dịch giấm ăn (CH3COOH).
- Tiến hành:
Bước 1: Đặt bình tam giác có chứa 10 ml giấm ăn và một mẫu giấy có chứa một thìa cafe bột NaHCO3, trên đĩa cân điện tử. Ghi chỉ số khối lượng hiện trên mặt cân (kí hiệu là ma).
Bước 2: Đổ bột NaHCO3 vào bình tam giác, đặt lại mẩu giấy lên đĩa cân, ghi chỉ số khối lượng hiện trên mặt cân (kí hiệu là mẹ).
Mô tả hiện tượng thí nghiệm: Sau khi đổ bột NaHCO3 vào bình tam giác chứa giấm, quan sát thấy khí CO2 được giải phóng ra và tạo thành bọt khí trong dung dịch giấm.
Chỉ số khối lượng:
ma: Khối lượng ban đầu của dung dịch giấm và mẫu giấy chứa NaHCO3.
mb: Khối lượng sau khi đã đổ bột NaHCO3 vào bình tam giác.
So sánh ma và mb: mb lớn hơn ma do trong quá trình phản ứng, có sự giải phóng khí CO2.
Giải thích: Phản ứng hoá học giữa acetic acid và sodium hydrogencarbonate tạo thành sodium acetate, carbon dioxide và nước theo sơ đồ:
Acetic acid + Sodium hydrogencarbonate → Sodium acetate + Carbon dioxide + Nước.
Tổng khối lượng của các chất tham gia phản ứng(acetic acid và sodium hydrogencarbonate) bằng tổng khối lượng của các chất sản phẩm (sodium acetate, carbon dioxide và nước), bao gồm cả khối lượng của khí CO2 bay ra.
II. Áp dụng định luật bảo toàn khối lượng
- Phương trình bảo toàn khối lượng
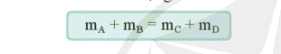
- Áp dụng định luật bảo toàn khối lượng để tính khối lượng các chất trong phản ứng hoá học
Ví dụ: Tính khối lượng NaCl tạo thành trong phản ứng hoá học khi biết các khối lượng của các chất khác trong phản ứng.
Trong phản ứng hoá học ở thí nghiệm 1, biết khối lượng của BaCl2 và Na2SO4 đã tham gia phản ứng lần lượt là 20,8 gam và 14,2 gam; khối lượng BaSO4 tạo thành là 23,3 gam. Tính khối lượng của NaCl tạo thành.
Phương trình bảo toàn khối lượng của các chất trong phản ứng là: Barium chloride + Sodium sulfate → Barium sulfate + Sodium chloride.
= Thay số vào ta được: mNaCl= 20,8 + 14,2 – 23,3 = 11,7 (g). Vậy khối lượng của NaCl tạo thành sau phản ứng là 11,7 gam.
III. Phương trình hóa học
- Phương trình hoá học là công thức hoá học của các chất tham gia phản ứng và sản phẩm tạo thành.
Ví dụ: 2H2 + O2 → 2 H2O
- Các bước lập phương trình hoá học
+ Viết sơ đồ phản ứng từ công thức hoá học của các chất tham gia và sản phẩm.
+ So sánh số nguyên tử của mỗi nguyên tố trong các chất và cân bằng nếu cần thiết.
+ Cân bằng số nguyên tử của mỗi nguyên tố bằng cách thêm hệ số phù hợp vào các chất.
+ Kiểm tra và viết phương trình hoá học. Lưu ý cân bằng cả các nhóm nguyên tử không thay đổi trong phản ứng.
- Ý nghĩa của phương trình hoá học
Phương trình hoá học cho biết chất tham gia phản ứng và chất sản phẩm, cũng như tỉ lệ về số nguyên tử hoặc số phân tử giữa các chất trong phản ứng. Tỉ lệ này bằng đúng tỉ lệ hệ số của mỗi chất trong phương trình hoá học.
IV. IV. Trắc nghiệm Khoa học tự nhiên 8 Kết nối tri thức Bài 3 (có đáp án)
Câu 1: Điền vào chỗ trống: "Trong một phản ứng hóa học, tổng khối lượng của các chất sản phẩm ... tổng khối lượng của các chất phản ứng."
A. Lớn hơn
B. Nhỏ hơn
C. Bằng
D. Nhỏ hơn hoặc bằng
Câu 2: Sơ đồ phản ứng hóa học của các chất: A+B⇒C+D. Phương trình bảo toàn khối lượng là:
A. mA + mC = mB + mD
B. mA + mD = mC + mB
C. mA + mB = mC + mD
D. mA + mB = mC - mD
Câu 3: Cho một thanh nhôm tác dụng với dung dịch hydrochloric acid thu được 26,7 gam muối nhôm và thấy có 0,6 gam khí hydrogen thoát ra. Tổng khối lượng của các chất phản ứng là:
A. 26 gam
B. 27,3 gam
C. 26,1 gam
D. 25,5 gam
Giải thích:
Ta có: Nhôm + hydrochloric acid → Muối nhôm + khí hydrogen
Theo định luật bảo toàn khối lượng, ta có: mNhôm + mhydrochloric acid = mMuối nhôm + mkhí hydrogen
Theo bài ra, ta có: mMuối nhôm = 26,7 gam; mkhí hydrogen = 0,6 gam
→ Tổng khối lượng của các chất phản ứng là: mNhôm + mhydrochloric acid = 26,7+0,6 = 27,3 gam.
Câu 4: Một vật thể bằng sắt để ngoài trời, sau một thời gian bị gỉ. Hỏi khối lượng của vật thay đổi thế nào so với khối lượng của vật trước khi gỉ?
A. Tăng
B. Giảm
C. Không thay đổi
D. Không thể biết
Giải thích:
Khi một vật thể bằng sắt để ngoài trời sẽ xảy ra quá trình oxi hóa trong không khí trong thời gian dài sẽ bị gỉ. Sau quá trình sẽ tạo ra chất mới là oxit của sắt do đó khối thượng của vật thay đổi sẽ tăng hơn so với khối lượng của vật trước khi gỉ.
Câu 5: Hệ số cân bằng hóa học của phương trình hóa học: H2 + O2 → H2O
A. 1, 2, 1
B. 2, 1, 1
C. 2, 2, 1
D. 2, 1, 2
Giải thích:
Khi cân bằng hóa học phương trình sẽ có dạng: 2H2 + O2 → 2H2O
Vậy hệ số cân bằng của phương trình hóa học là: 2: 1 : 2
>>> Xem toàn bộ: Lý thuyết Khoa học tự nhiên 8 Cánh Diều
-------------------------------------------
Trên đây Toploigiai đã cùng các bạn Lý thuyết Khoa học tự nhiên 8 Cánh Diều Bài 3. Định luật bảo toàn khối lượng, phương trình hóa học theo chương trình Sách mới ngắn gọn nhất. Mời các bạn hãy click ngay vào trang chủ Toploigiai để tham khảo và chuẩn bị bài cho năm học mới Lớp 8 nhé. Chúc các bạn học tốt.
