Trắc nghiệm Đúng sai Trả lời ngắn Hóa 12 Bài 15: Các phương pháp tách kim loại
Tổng hợp 20 câu Trắc nghiệm Đúng sai Trả lời ngắn Hóa 12 Bài 15: Các phương pháp tách kim loại có đáp án chi tiết bám sát chương trình học Sách mới năm học 2024-2025
Phần 1. Trắc nghiệm Đúng Sai
Câu 1. Các nguyên tố kim loại tồn tại trong vỏ Trái Đất, nước mặt, nước ngầm và cơ thể sinh vật.
A. Quặng hematite, pyrite, chalcopyrite đều có chứa nguyên tố iron
B. Quặng kim loại chứa các khoáng vật tạo bởi hợp chất của kim loại hoặc đơn chất kim loại và tạp chất.
C. Trong tự nhiên, hầu hết các kim loại tồn tại ở dạng hợp chất (oxide, muối,...) trong quặng, chỉ một số kim loại kém hoạt động như vàng, bạc, platinum,... được tìm thấy dưới dạng đơn chất.
D. Trong nước mặt và nước ngầm, các nguyên tô kim loại tồn tại ở dạng cation, như Na+, Mg2+, Ca2+,...Trong cơ thể sinh vật, nguyên tố phosphorus có nhiều trong xương và răng; các nguyên tố như potassium, sắt, đồng,... có trong máu.
A. đúng
B. đúng
C. đúng
Câu 2. Từ quặng kim loại, qua giai đoạn xử lí, ta thường thu được hợp chất của kim loại. Trong hợp chất, nguyên tố kim loại tồn tại dạng cation kim loại (M+). Để thu được nguyên tố kim loại theo mong muốn, ta cần thực hiện phương pháp tách kim loại.
A. Để tách được nguyên tố kim loại ra khỏi hợp chất là quá trình oxi hóa cation kim loại thành nguyên tử kim loại
B. Phương pháp điện phân vừa có thể dùng để điều chế các kim loại mạnh, vừa có thể được áp dụng để điều chế các kim loại hoạt động trung bình và yếu như Zn, Cu, Ag,...
C. Phương pháp nhiệt luyện được thực hiện bằng cách khử những ion của kim loại hoạt động trung bình và yếu (như Zn, Fe, Sn, Pb, Cu, ...) trong các oxide của chúng ở nhiệt độ cao bằng các chất oxi hóa mạnh như C, CO,...
D. Cơ sở của phương pháp thủy luyện là dùng những dung dịch thích hợp như dung dịch H2SO4, NaOH, NaCN,... để hoà tan kim loại hoặc hợp chất của kim loại, tách phần không tan ra khỏi dung dịch. Sau đó oxi hóa những ion kim loại này trong dung dịch bằng kim loại có tính khử mạnh hơn như Fe, Zn,....
B. đúng
Câu 3. Khi nói về quá trình tách một số kim loại, hãy xác định nhận định sau đây đúng hay sai
A. Tách sắt từ quặng hematite ở nhiệt độ cao, sắt được tách ra khỏi iron(III) oxide bởi carbon monoxide là ứng dụng của phương pháp nhiệt luyện
B. Kim loại kẽm được tách từ hợp chat zinc sulfide trong khoáng vật sphalerite. Trước tiên, đốt zinc sulfide trong khí oxygen dư để tạo zinc oxide và sulfur dioxide. Để thu được zinc, có thể khử zinc oxide bằng carbon. Cách làm này là ứng dụng của phương pháp nhiệt luyện và điện phân nóng chảy.
C. Khi điện phân dung dịch MgCl2 , MgCl2 phân li thành các ion Mg2+ và ion Cl-. Cation Mg2+ di chuyển về cực âm (cathode) và anion Cl- di chuyển về cực dương (anode) của bình điện phân.
D. Tách kim loại bạc ra khỏi hỗn hợp kim loại bạc và đồng, ta hòa tan hỗn hợp vào dung dịch AgNO3, đợi một thời gian để phản ứng xảy ra hoàn toàn, ta lại tiến hành lọc phần chất rắn còn sót lại trong ống nghiệm, thu được bạc. Cách làm này là ứng dụng của phương pháp thủy luyện.
A. đúng
D. đúng
Câu 4. Hiện nay, trữ lượng các mỏ quặng kim loại ngày càng cạn kiệt, trong khi nhu cầu sử dụng kim loại ngày càng tăng và lượng phế thải kim loại tạo ra ngày càng nhiều. Do đó, tái chế kim loại là công việc cần thiết, vừa đảm bảo nguồn cung, vừa gia tăng giá trị kinh tế, bảo vệ môi trường và thực hiện mục tiêu phát triển bền vững.
A. Tái chế là quá trình xử lí để tái sử dụng rác thải hoặc vật liệu không cần thiết (phế liệu) thành vật liệu mới mang lại lợi ích cho đời sống và sản xuất.
B. Tái chế kim loại là quá trình thu kim loại từ các phế liệu kim loại.
C. Kim loại là vật liệu có thể được tái chế nhiều lần nhưng sẽ làm thay đổi tính chất cũng như làm giảm chất lượng của chúng. Còn phế liệu kim loại là các kim loại, hợp kim có trong thiết bị, máy móc, vật dụng hỏng, cũ, không còn sử dụng được nữa.
D. Quy trình tái chế kim loại thường gồm các giai đoạn: thu gom, phân loại; xử lí sơ bộ; phối trộn phế liệu; nấu chảy; đúc, chế tạo, gia công; tinh chế.
A. đúng
B. đúng
Câu 5. Để tách kim loại từ quặng, có nhiều phương pháp, trong đó ba phương pháp phổ biến là nhiệt luyện, thuỷ luyện và điện phân.
A. Để tách kim loại M ra khỏi các hợp chất của nó cần khử cation Mn+ thành kim loại.
B. Các kim loại như Na, Mg, Al thường được tách ra khỏi hợp chất bằng phương pháp điện phân nóng chảy.
C. Các kim loại như Zn, Fe, Cu, Ag thường được tách ra khỏi hợp chất bằng phương pháp nhiệt luyện hoặc phương pháp thuỷ luyện.
D. Tách những kim loại hoạt động hoá học trung bình và yếu có thể sử dụng phương pháp nhiệt luyện hoặc điện phân dung dịch muối.
A. đúng
B. đúng
C. đúng
D. đúng
Câu 6. Quặng bauxite (thành phần chính Al2O3.2H2O) thường lẫn tạp chất. Sau khi loại bỏ tạp chất bằng phương pháp hoá học thu được Al2O3. Do Al2O3 có nhiệt độ nóng chảy rất cao (2050 °C) nên Al2O3 được trộn cùng với cryolite (Na3AlF6) để tạo thành hỗn hợp nóng chảy ở gần 1000 °C.
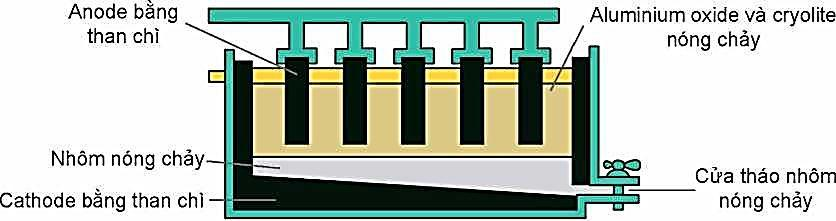
Sơ đồ thùng điện phân Al2O3
A. Xúc tác cryolite tuy tiết kiệm nhiều năng lượng cũng như giảm giá thành chế tạo thùng điện phân., đồng thời tạo ra chất lỏng vừa có tính dẫn điện tốt, vừa nổi lên trên Al lỏng để ngăn cách Al lỏng với không khí
B. Phương pháp được sử dụng để tách Al từ Al2O3 (tinh chế từ quặng bauxite) là điện phân nóng chảy
C. Khí O2 tạo thành ở nhiệt độ cao, đốt cháy dần điện cực anode than chì thành CO và CO2. Do vậy, trong quá trình điện phân phải hạ thấp dần các điện cực anode vào thùng điện phân.
D. Ở cực âm xảy ra sự oxi hoá ion O2–, cực dương xảy ra sự khử ion Al3+
A. đúng
B. đúng
C. đúng
Câu 7. Phương pháp tách kim loại giúp tách kim loại mong muốn ra khỏi hỗn hợp hoặc hợp chất kim loại đó
A. Để tách rời nhôm ra khỏi hỗn hợp có lẫn Cu, Ag, Fe ta có thể dùng cách sau: Dùng dung dịch HNO3 loãng, NaOH dư, lọc, thổi CO2, nhiệt phân, điện phân nóng chảy.
B. Để tách riêng các chất khỏi hỗn hợp gồm Fe, Cu, Al có thể dùng các hóa chất là NaOH và HCl (không kể các phương pháp vật lý)
C. Có hỗn hợp 3 kim loại Al, Fe, Zn. Hoá chất có thể dùng để tách Fe khỏi hỗn hợp là dung dịch kiềm
D. Phương pháp hoá học để có thể tách riêng từng kim loại ra khỏi một dung dịch có chứa các muối FeSO4 và CuSO4 là : Cho sắt vào dung dịch thu được Cu sau đó thu được dung dịch FeSO4 → đưa về Fe2O3 → dùng CO khử
A. đúng
B. đúng
C. đúng
D. đúng
Câu 8. Phương pháp tách kim loại giúp tách kim loại mong muốn ra khỏi hỗn hợp hoặc hợp chất kim loại đó
A. Để tách Al3+ ra khỏi hỗn hợp với Cu2+ ; Zn2+ ; Ag+ ta có thể dùng dung dịch NH3 hoặc NaOH
B. Để tách lấy Ag ra khỏi hỗn hợp gồm Cu, Zn, Ag ta dùng lượng dư dung dịch FeSO4
C. Một hỗn hợp gồm Al, Fe, Cu và Ag. Bằng phương pháp hóa học không thể tách rời hoàn toàn các kim loại ra khỏi hỗn hợp trên.
D. Phương pháp hoá học để có thể tách riêng từng kim loại ra khỏi một dung dịch có chứa các muối NaCl và CuCl2 là : Dùng NaOH → thu được dd NaCl điện phân nóng chảy thu được NA. Nung kết tủa Cu(OH)2 → CuO dùng CO khử
D. đúng
Câu 9. Trong tự nhiên, hầu hết các kim loại tồn tại ở dạng hợp chất (oxide, muối,...) trong quặng, chỉ một số kim loại kém hoạt động như vàng, bạc, platinum,... được tìm thấy dưới dạng đơn chất.
A. Một loại quặng chứa sắt trong tự nhiên đã được loại bỏ tạp chất. Hòa tan quặng này trong dung dịch HNO3 thấy có khí màu nâu bay ra, dung dịch thu được cho tác dụng với BaCl2 có thấy kết tủa màu trắng (không tan trong acid mạnh). Loại quặng đó là pirit sắt.
B. Trong các loại quặng sau : Xiđerit, Hemantit, Manhetit, Pirit sắt. Quặng Manhetit chứa hàm lượng sắt cao nhất ; quặng Pirit sắt chứa hàm lượng sắt thấp nhất
C. Quặng kim loại chứa các khoáng vật tạo bởi hợp chất của kim loại hoặc đơn chất kim loại và tạp chất.
D. Quặng hematite, pyrite, chalcopyrite đều có chứa nguyên tố iron và sulfur
A. đúng
C. đúng
Câu 10. Từ quặng kim loại, qua giai đoạn xử lí, ta thường thu được hợp chất của kim loại. Trong hợp chất, nguyên tố kim loại tồn tại dạng cation kim loại (M+). Để thu được nguyên tố kim loại theo mong muốn, ta cần thực hiện phương pháp tách kim loại.
A. Phương pháp thường điện phân hợp chất nóng chảy sử dụng để điều chế các kim loại có tính khử yếu.
B. Phương pháp nhiệt luyện dùng để sản xuất các kim loại có tính khử trung bình và mạnh (Zn, Fe, Sn, Pb, …) trong công nghiệp.
C. Phương pháp thuỷ luyện dùng điều chế các kim loại hoạt động hoá học mạnh như K, Na, Ca, Mg, Al
D. Phương pháp điện phân dung dịch dùng để điều chế các kim loại có độ hoạt động hoá học mạnh hoặc yếu.
Phần 2. Trắc nghiệm Trả lời ngắn
Câu 1. Người ta điều chế Al từ một quặng có chứa 15% tạp chất trơ. Biết hiệu suất phản ứng đạt 85%. Khối lượng Al thu được từ 4 tấn quặng trên là bao nhiêu tấn ?
Đáp án:
mAl2O3 = 4. 85% = 3,4 (tấn)
Điện phân nóng chảy, xúc tác cryolite : 2Al2O3 → 4Al + 3O2
Ta có : Cứ (2.102 = 204) tấn Al2O3 → (4.27 = 108) tấn Al
3,4 tấn Al2O3 → 1,8 tấn Al
Do H = 80% nên mAl = 1,8.85% = 1,53 (tấn)
Câu 2. Số kim loại không thể tách bằng phương pháp điện phân các hợp chất điện li nóng chảy của kim loại trong các kim loại sau: K, Sn, Ca, Pb, Mg, Al, Zn, Cu, Fe, Ag là bao nhiêu ?
Đáp án: 6
Sn, Pb, Zn, Cu, Fe, Ag
Câu 3. Có bao nhiêu ion kim loại bị Zn khử thành kim loại trong các ion sau : Fe3+, Cu2+, Mg2+, Pb2+, Cu2+, Ag+, Na+, Sn2+, Al3+ ?
Đáp án: 5 ion
🡪 Là các kim loại đứng sau Zn : Fe3+, Pb2+, Cu2+, Ag+, Sn2+
Câu 4. Điện phân hoàn toàn 38 gam muối chloride nóng chảy của một kim loại R thuộc nhóm IIA, người ta thu được 9,916 lít khí chlorine (đkc). Số hạt không mang điện trong hạt nhân nguyên tử R là bao nhiêu ?
Đáp án:
RCl2 → R + Cl2
0,4 ← 9,916 / 24,79 = 0,4 (mol)
Ta có: Mmuối . nmuối = mmuối 🡪 (MR + 2.35,5). 0,4 = 38 🡪 MR = 24 🡪 R là Mg
Neutron = 12
Câu 5. Ngâm một vật bằng đồng có khối lượng 35 gam trong 625 gam dung dịch AgNO3 8,5%. Khi lấy vật ra thì lượng AgNO3 trong dung dịch giảm 16%. Sau phản ứng thu được m gam chất rắn. Tính giá trị m .
Đáp án:
+ mAgNO3 (ban đầu) = 625. 8,5% = 53,125 (gam)
+ mAgNO3 (phản ứng) = 53,125. 16% = 8,5 (gam) (Lượng giảm đi là lượng phản ứng)
🡪 nAgNO3 (phản ứng) = 0,05 (mol)
Ta thấy : 35/ 64 = 0,55 > 0,05 🡪 Cu dư, AgNO3 phản ứng hết
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,025 ← 0,05 → 0,05 (mol)
Khối lượng vật sau phản ứng = Khối lượng Cu dư + Khối lượng Ag
= mCu (ban đầu) – mCu (phản ứng) + mAg
= 35 – 0,025. 64 + 0,05. 108 = 38,8 (g)
Câu 6. Người ta đốt một tấn quặng sắt (FeS2 ) chứa 60% là (FeS2) cần dùng chứa 352 kg O2 thu được 64 kg SO2 và Fe2O3, biết hiệu suất của phản ứng là 80 %. Dẫn khí CO qua Fe2O3 thu được , sau phản ứng có bao nhiêu kilogram iron tạo thành ? (kết quả làm tròn đến hàng đơn vị)
Đáp án:
+ mFeS2 (có trong quặng) = 60%. 1= 0,6 tấn = 600 (kg)
+ H = 80% => mSO2 (lí thuyết) = 64 / 80% = 80 (kg)
+ Bảo toàn khối lượng => mFe2O3 (lí thuyết) = mFeS2 + mO2 – mSO2= 600 + 352 – 80 = 872 (kg)
+ Vì H = 80% => mFe2O3 (thực tế thu được) = 872. 80% = 697,6 (kg)
+ Fe2O3 + 3CO → 2Fe + 3CO2 ↑
Ta thấy : 160 kg Fe2O3 🡪 (2.56=112) kg Fe
697,6 kg Fe2O3 🡪 488 kg Fe
Câu 7. Ngâm một miếng kẽm sạch trong 250mL dung dịch AgNO3. Sau khi phản ứng kết thúc, lấy miếng kẽm ra khỏi dung dịch rửa sạch nhẹ bằng nước cất và sấy khô rồi đem cân thấy khối lượng miếng kẽm tăng 0,95 gam so với ban đầu. Tính ồng độ mol của dung dịch AgNO3 đã dùng. (Làm tròn kết quả đến hàng phần trăm)
Đáp án:
Gọi Nồng độ mol của dung dịch CuSO4 là x (M) 🡪 nCuSO4 = 0,25x (mol)
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
0,125x ← 0,25x → 0,25x (mol)
Ta có : mZn tăng = mAg bám vào – mZn (phản ứng) 🡪 0,95 = 0,25x. 108 – 0,125x . 65 🡪 x = 0,05 (M)
Câu 8. Cho m gam Mg vào 100 ml dung dịch A chứa Zn(NO3)2 và AgNO3, phản ứng hoàn toàn cho ra dung dịch X chứa 2 ion kim loại và một chất rắn Y nặng 5,08 gam. Cho Y tác dụng với dung dịch HCl dư ở điều kiện thường, còn lại một chất rắn Z không tan nặng 3,78 gam. Tính m. (Làm tròn kết quả đến hàng phần trăm)
Đáp án:
Al + 3AgNO3 → Al(NO3)3 + 3Ag
2Al + 3Zn(NO3)2 → 2Al(NO3)3 + 3Zn
Theo bài ta suy ra: Mg tan hết, CuCl2 phản ứng hết, ZnCl2 còn dư.
⇒ mAg = mZ không tan = 3,78g ⇒ nAg = 3,78/108 = 0,035 mol
⇒ mZn = mY – mAg = 5,08 - 3,78 = 1,3 g ⇒ nZn = 1,3/65 = 0,02 mol
⇒ nAl = nAg/3 + 2/3 .nZn = 0,025 mol ⇒ mMg = 0,025.27= 0,675 gam 🡪 m = 0,68
Câu 9. Trong những oxit sau: ZnO, CuO, MgO, Al2O3, Ag2O, FeO, Fe2O3 , Na2O, CaO , SnO, Ni2O3.
Ở nhiệt độ cao H2 khử được a oxide kim loại, CO khử được b oxide kim loại, C khử được a oxide kim loại trong dãy oxide trên. Tính a + b + c.
Đáp án:
H2 khử được : ZnO, CuO, Ag2O, FeO, Fe2O3 , SnO, Ni2O3 🡪 a = 7
CO khử được : CuO, Ag2O, FeO, Fe2O3 , SnO, Ni2O3 🡪 b = 6
C khử được : ZnO, CuO, MgO, Al2O3, Ag2O, FeO, Fe2O3, Na2O, CaO, SnO, Ni2O3 🡪 c = 11
a + b + c = 7 + 6 + 11 = 24
Câu 10. Khử 1,5 tấn quặng hematite (thành phần chính là Fe2O3) chứa 30% tạp chất trơ bằng khí hydrogen ở nhiệt độ cao. Biết rằng hiệu suất phản ứng H = 83%. Tính số tấn Fe thu được từ quá trình tinh chế trên (Làm tròn kết quả đến hàng phần trăm)
Đáp án:
Ta có : mFe2O3 = 1,05 tấn
Fe2O3 + 3H2 → 2Fe + 3H2O
Ta có : Cứ 160 tấn Fe2O3 → (2.56 = 112) tấn Fe
🡪 1,05 tấn Fe2O3 → 0,735 tấn Fe
Vì H = 75% nên khối lượng Fe thu được là m = 0,735.83% = 0,61 (tấn)
