Trắc nghiệm Đúng sai Trả lời ngắn Hóa 12 Bài 17: Nguyên tố nhóm IA
Tổng hợp 20 câu Trắc nghiệm Đúng sai Trả lời ngắn Hóa 12 Bài 17: Nguyên tố nhóm IA có đáp án chi tiết bám sát chương trình học Sách mới năm học 2024-2025
Phần 1. Trắc nghiệm Đúng Sai
Câu 1. Nhóm kim loại kiềm (nhóm IA trong bảng tuần hoàn) bao gồm 5 nguyên tố: lithium (Li); sodium (Na); potassium (K); rubidium (Rb); caesium (Cs), francium (Fr) (francium là nguyên tố phóng xạ nhân tạo, không bền).
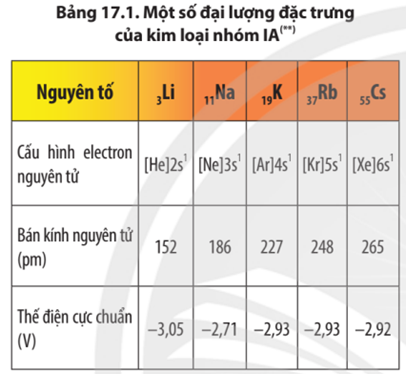
A. Cấu hình electron lớp ngoài cùng các nguyên tử kim loại kiềm là ns1.
B. Ở trạng thái cơ bản, các nguyên tử kim loại kiềm đều có 1 electron độc thân.
C. Trong các hợp chất, kim loại nhóm IA đều thể hiện số oxi hóa +1.
D. Kim loại nhóm IA có thế điện cực chuẩn rất nhỏ nên dễ tách electron hóa trị ra khỏi nguyên tử. Vì vậy, trong các phản ứng hóa học kim loại kiềm thể hiện tính oxi hóa rất mạnh.
A. đúng
B. đúng
C. đúng
Câu 2. Trong tự nhiên, các kim loại kiềm tồn tại ở dạng khoáng vật, phổ biến như khoáng vật halite, sylvinite, carnallite...
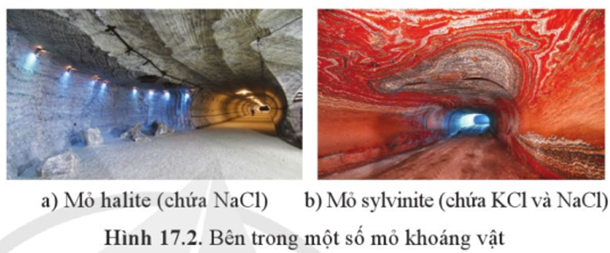
A. Trong nhóm kim loại kiềm, kim loại sodium và potassium phổ biến hơn các nguyên tố còn lại.
B. Ngoài khai thác từ nước biển, muối ăn còn được khai thác từ mỏ muối.
C. Trong tự nhiên, các kim loại kiềm chỉ tồn tại ở dạng hợp chất.
D. Khoáng vật carnallite có thành phần chính là KCl.CaCl2.6H2O.
A. đúng
B. đúng
C. đúng
Câu 3. Bên cạnh tính chất vật lí chung của các kim loại, các đơn chất kim loại nhóm IA còn có một số tính chất vật lí đặc trưng
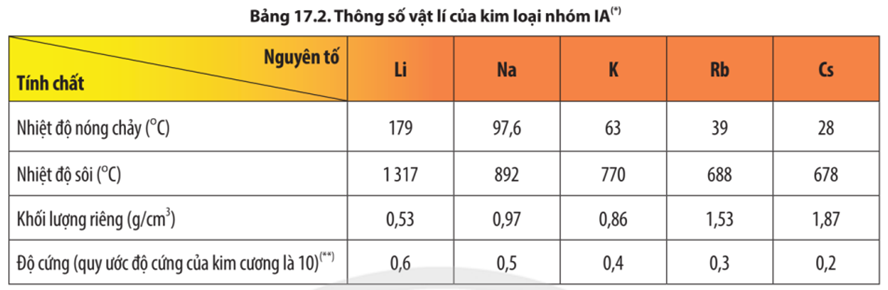
A. Tất cả kim loại nhóm IA đều là kim loại nhẹ, lithium là kim loại nhẹ nhất trong tất cả các kim loại.
B. Nhiệt độ nóng chảy của các kim loại nhóm IA có xu hướng giảm dần theo chiều tăng của điện tích hạt nhân nguyên tử.
C. Kim loại nhóm IA có nhiệt độ nóng chảy thấp, độ cứng thấp là do trong tinh thể các ion kim loại liên kết với nhau bằng liên kết kim loại yếu.
D. Khối lượng riêng của các kim loại nhóm IA tăng dần từ Li đến Cs.
A. đúng
B. đúng
C. đúng
Câu 4. Kim loại nhóm IA có tính khử mạnh, tính khử tăng dần từ Li đến Cs
A. Sodium cháy trong không khí thu được sản phẩm Na2O2
B. Ở điều kiện thường, Li bốc cháy khi tiếp xúc với khí Cl2
C. Tất cả kim loại nhóm IA đều tác dụng với nước tạo thành dung dịch kiềm.
D. Trong PTN, kim loại lithium được bảo quản bằng cách ngâm trong dầu hỏa.
C. đúng
Câu 5. Phần lớn các hợp chất của kim loại nhóm IA tan tốt trong nước, khi tan trong nước phân li thành ion.
A. Hợp chất của các kim loại kiềm có thể phân biệt bằng cách đốt chúng trên ngọn lửa không màu.
B. Hợp chất của lithium cháy cho ngọn lửa màu tím nhạt.
C. Hợp chất của sodium cháy cho ngọn lửa màu vàng.
D. Hợp chất của potassium cháy cho ngọn lửa màu xanh nhạt.
A. đúng
C. đúng
Câu 6. Khi nồng độ axit trong dịch vị dạ dày tăng có thể gây ra viêm loét dạ dày, tá tràng. Để giảm bớt nồng độ axit trong dịch vị dạ dày người ta thường dùng “thuốc đau dạ dày”. Thành phần chính của “thuốc đau dạ dày” là muối X.
A. Muối X là sodium bicarbonate có công thức hóa học là Na2CO3
B. Muối X còn được dùng để tạo độ xốp cho bánh, làm mềm thực phẩm.
C. Muối X bị phân hủy khi đun nóng.
D. Trong công nghiệp, muối X được sản xuất bằng phương pháp Solvay.
B. đúng
C. đúng
D. đúng
Câu 7. Trong công nghiệp, NaOH được điều chế bằng cách điện phân dung dịch NaCl với điện cực trơ, màng ngăn điện cực xốp. Phương trình hóa học của phản ứng điện phân là
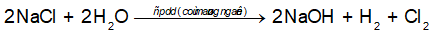
A. Ở cực âm, xảy ra quá trình khử ion Na+.
B. Khí H2 và khí Cl2 đều thu được ở cực dương.
C. Khí Cl2 thu được ở cực âm, khí H2 thu được ở cực dương.
D. Nếu không có màng ngăn, Cl2 và NaOH phản ứng với nhau tạo thành nước Javel.
D. đúng
Câu 8. Trong công nghiệp, một lượng lớn soda được sản xuất bằng phương pháp Solvay từ những nguyên liệu phổ biến nên sản phẩm soda có giá thành không cao.
A. Phương pháp Solvay còn được gọi là phương pháp tuần hoàn ammonia.
B. Phản ứng 2NaCl + 2NH3 + CO2 + H2O → Na2CO3 + 2NH4Cl xảy ra được là do Na2CO3 ít tan hơn các muối khác nên kết tinh trước.
C. Soda được dùng để tẩy rửa dầu mỡ trong đường ống dẫn của bồn rửa hoặc trên bề mặt dụng cụ nhà bếp.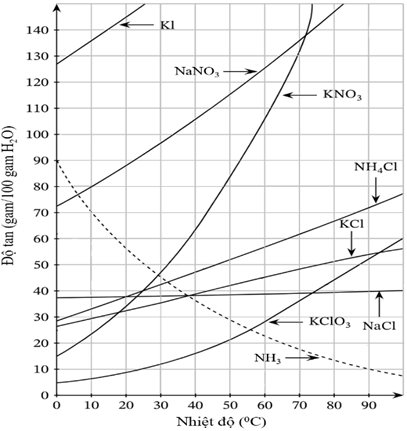
D. Muối NaHCO3 tan nhiều trong nước hơn muốn Na2CO3.
A. đúng
C. đúng
Câu 9. Giản đồ hình bên mô tả sự biến đổi độ tan trong nước của một số chất theo nhiệt độ.
A. Ở nhiệt độ phòng, KNO3 là chất tan ít nhất, KI là chất tan nhiều nhất.
B. Khi nhiệt độ tăng, độ tan của các muối sẽ tăng.
C. Độ tan của NaCl ít phụ thuộc vào nhiệt độ nhất
D. Để tách riêng NaCl và KCl ra khỏi quặng sylvinite (NaCl.KCl), người ta vào độ tan khác nhau của chúng.
B. đúng
C. đúng
D. đúng
Câu 10. Để xác định nồng độ axit axetic có trong một mẫu giấm ăn, một nhóm học sinh tiến hành thí nghiệm sau:
- Bước 1: Pha loãng 10,00 mL giấm ăn bằng nước cất trong bình định mức được 100,00 mL dung dịch X. Dùng pipet lấy 10,00 mL dung dịch X cho vào bình tam giác rồi thêm vài giọt chất chỉ thị phenolphtalein.
- Bước 2: Tráng sạch buret bằng nước cất, sau đó tráng lại bằng một ít dung dịch NaOH 0,02 M. Lắp dụng cụ như hình bên. Cho dung dịch NaOH 0,02 M vào cốc thủy tinh, sau đó rót vào buret (đã khóa) và chỉnh về vạch 0.
- Bước 3: Vặn khóa buret để dung dịch NaOH trong buret chảy từ từ từng giọt vào bình tam giác đồng thời lắc đều bình. Quan sát đến khi dung dịch trong bình tam giác chuyển từ không màu sang màu hồng bền trong khoảng 20 giây thì dừng lại.
- Bước 4: Ghi lại thể tích dung dịch NaOH đã dùng.
Lặp lại thí nghiệm 3 lần.
Thể tích dung dịch NaOH 0,02 M trong 3 lần thí nghiệm được ghi lại như sau:
| Lần 1 | Lần 2 | Lần 3 | |
| VNaOH (mL) | 37,5 | 37,4 | 37,6 |
A. Phương trình phản ứng xảy ra ở thí nghiệm trên là: HCOOH + NaOH → HCOONa + H2O.
B. Để rút ngắn thời gian chuẩn độ, ta có thể làm thí nghiệm một lần nhưng phải cẩn thận.
C. Cân chính xác 0,08 gam NaOH hoàn tan hoàn toàn trong bình định mức 100 mL thu được dung dịch NaOH 0,02M.
D. Từ kết quả ở trên, ta tính được nồng độ của dung dịch giấm ăn ban đầu là 0,5M.
C. đúng
Phần 2. Trắc nghiệm Trả lời ngắn
Câu 1. Tính khối lượng NaOH cần dùng để pha được 100 ml dung dịch NaOH có pH=12.
Đáp án:
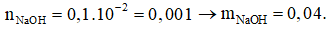
Câu 2. Nước muối sinh lí thường là dung dịch NaCl 0,9%. Nêu cách pha chế để thu được 500 ml dung dịch NaCl 0,9% (D = 1,009 gam/ml) từ NaCl nguyên chất và nước cất.
Đáp án:
mNaCl = 500 . 1,009 . 0,9% = 4,5405
Câu 3. Baking soda bị phân hủy khi đun nóng tạo thành soda. Tổng hệ số (nguyên, tối giản) của các chất trong phương trình phản ứng phân hủy baking soda là
Đáp án:
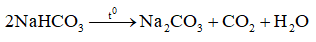
Câu 4. Trong quá trình sản xuất soda bằng phương pháp Solvay đi từ các nguyên liệu đầu là muối ăn, đá vôi và ammoniA. Số phương trình hóa học đã xảy ra là
Đáp án: Số phương trình hóa học đã xảy ra là 3.
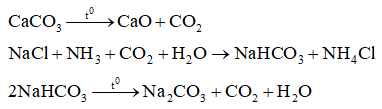
Câu 5. Cho các nguyên tố: Kr, Ca, Sr, Li, Ni, RB. Có bao nhiêu nguyên tố là kim loại nhóm IA?
Đáp án: Có 1 nguyên tố là kim loại nhóm IA là Li
Câu 6. Dung dịch của các chất sau đều không màu: NaCl, Na2SO4, KCl, LiNO3. Chỉ dùng ngọn lừa không màu có thể nhận biết được bao nhiêu dung dịch?
Đáp án:
Nhận biết được 2 dung dịch là KCl và LiNO3
Đốt KCl tạo ra ngọn lửa màu tím nhạt.
Đốt LiNO3 tạo ra ngọn lửa màu đỏ tía.
Đốt NaCl và Na2SO4 đều tạo ra ngọn lửa có màu vàng.
Câu 7. Cho phương trình hóa học: KOH(đ) + Cl2 → KCl + KClO3 + H2O
Tỉ lệ giữa số nguyên tử chlorine đóng vai trò là chất khử và số nguyên tử chlorine đóng vai trò là chất oxi hóa là
Đáp án:
6KOH(đ) + 3Cl2 → 5KCl + KClO3 + 3H2O
Câu 8. Hạ nhiệt độ 128,3 gam dung dịch Na2SO4 bão hòa ở 80°C xuống 10°C thấy có m gam tinh thể Na2SO4.10H2O tách ra. Biết độ tan của Na2SO4 ở 80°C là 28,3 gam và ở 10°C là 9,0 gam. Giá trị của m gần nhất với giá trị?
Đáp án:
Khối lượng Na2SO4 trong dung dịch bão hòa ở 80oC là 28,3 gam
Đặt khối lượng Na2SO4.10H2O tách ra là x
Ta có phương trình:
Þ x=49,4
Câu 9. Để xác định công thức của một khoáng vật X, người ta tiến hành các thí nghiệm sau:
- Thí nghiệm 1: Cho 14,8 gam X tác dụng với lượng dư dung dịch axit HCl thu được 1,9832 lít (đkc) khí Y không màu, không mùi, làm đục nước vôi trong nhưng không làm mất màu nước brom.
- Thí nghiệm 2: Nung nóng m gam X ở 2000C thu được 159m / 370 gam chất rắn Z (chỉ chứa một chất), hỗn hợp gồm khí và hơi không màu, không mùi. Nếu tiếp tục nung nóng Z ở nhiệt độ cao hơn thì khối lượng vẫn không đổi. Lấy 2,12 gam Z cho tác dụng với lượng dư dung dịch axit HCl thu được 0,4958 lít (đkc) khí Y.
Số nguyên tử oxygen trong X là
Đáp án:
- Khí Y là CO2.
- Chất rắn Z không bị nhiệt phân ở nhiệt độ cao và giải phóng khí khi tác dụng với dung dịch HCl Þ Z là muối cacbonat của kim loại kiềm M2CO3.
- Xét phản ứng của Z với dung dịch HCl:
M2CO3 + 2HCl → 2MCl + H2O + CO2
Þ nZ = nCO2 = 0,4958 / 24,79 = 0,02 mol
Þ MZ = 2,12 / 0,02 = 106 = 2MM + 60 Þ MM = 23 Þ M là Na.
- Gọi công thức của X là xNa2CO3.yNaHCO3.zH2O (x Î N; y, z Î N*); nX = a (a > 0)
Þ mX = a(106x + 84y + 18z) = 14,8 (1)
- Xét phản ứng của X với HCl: nCO2 = 1,9832 / 24,79 = 0,08 mol
Þ nCO2 = a.(x + y) = 0,08 (2)
- Phản ứng nung nóng X:
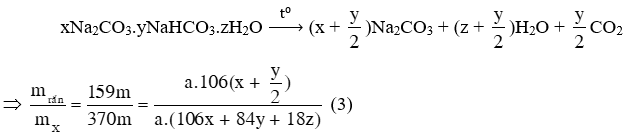
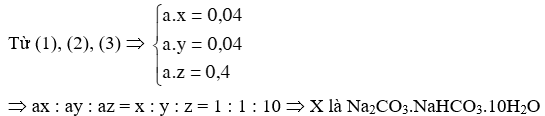
Þ Tổng số nguyên tử oxygen trong X là 16
Câu 10. Cho 8,85 gam hỗn hợp A gồm M2O, MOH, M2CO3 (M là kim loại nhóm IA) tác dụng vừa đủ với 73 gam dung dịch HCl 10%, sau phản ứng thu được 1,2395 lít khí CO2 và dung dịch B chỉ chứa một muối duy nhất có nồng độ 14,68%.
Phần trăm khối lượng của MOH trong hỗn hợp A là (kết quả làm tròn đến hàng phần mười)
Đáp án:

