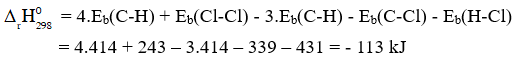Trắc nghiệm Đúng sai Trả lời ngắn Hóa 12 Bài 12: Thế điện cực và nguồn điện hoá học
Tổng hợp 20 câu Trắc nghiệm Đúng sai Trả lời ngắn Hóa 12 Bài 12: Thế điện cực và nguồn điện hoá học có đáp án chi tiết bám sát chương trình học Sách mới năm học 2024-2025
Phần 1. Trắc nghiệm Đúng Sai
Câu 1: Pin Galvani Zn-Cu được mô phỏng trong hình 12.1, các quá trình xảy ra trong pin là
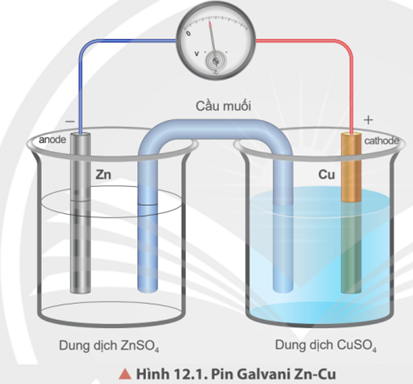
A. Không xuất hiện dòng điện
B. Dòng điện chạy từ cực âm sang cực dương
C. Dòng điện chạy từ cực dương sang cực âm.
D. Điện cực âm xảy ra quá trình oxi hoá, điện cực dương xảy ra quá trình khử
B. đúng
D. đúng
Câu 2. Trong pin Galvani
A. Điện cực có giá trị thế điện cực lớn hơn đóng vai trò cực âm, điện cực có giá trị thế điện cực nhỏ hơn đóng vai trò cực dương.
B. Suất điện động của pin đo bằng Ampe kế.
C. Suất điện động của pin đo bằng Von kế.
D. Epin = E+ - E-
C. đúng
D. đúng
Câu 3. Giá trị thế điện cực chuẩn của một số cặp oxi hoá - khử như sau
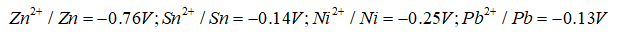
A. Tính oxi hoá được xếp tăng dần theo thứ tự Zn2+/Zn < Ni2+/Ni < Pb2+/Pb < Sn2+/Sn
B. Tính khử giảm dần theo thứ tự Zn2+/Zn < Ni2+/Ni < Sn2+/Sn < Pb2+/Pb
C. Suất điện động chuẩn của pin tạo bởi hai cặp oxi hoá – khử Zn2+/Zn và Pb2+/Pb là 0.63V
D. Nếu Pin tạo bởi hai cặp oxi hoá – khử Ni2+/Ni và Sn2+/Sn thì trong pin cực âm là Sn, cực dương là Ni
B. đúng
C. đúng
Câu 4. Chiều của các phản ứng hoá học xảy ra giữa các cặp oxi hoá – khử
1. Cu2+/Cu, Zn2+/Zn ;
2. Zn2+/Zn, Ag+/Ag ;
3. Cu2+/Cu, Ag+/Ag biết giá trị thế điện cực chuẩn các cặp oxi hoá khử Cu2+/Cu = 0.34V ; Zn2+/Zn = -0.76V ; Ag+/Ag =0.8V
A. Cu2+ + Zn → Cu + Zn2+
B. Zn2+ + Cu → Zn + Cu2+
C. 2Ag + Zn2+ → 2Ag+ + Zn
D. Cu + 2Ag+ → Cu2+ + 2Ag
A. đúng
D. đúng
Câu 5. Nhận định những phát biểu sau đây
A. Trong pin Galvani Zn đóng vai trò cực âm, Cu đóng vai trò cực dương
B. Điện cực âm, anode xảy ra quá trình khử Zn
C. Điện cực dương, cathode xảy ra quá trình oxi hoá Cu
D. Dòng điện chạy từ Zn sang Cu
A. đúng
D. đúng
Câu 6. Các thí nghiệm có giá trị vôn kế khác 0
A. Cắm hai thanh kim loại khác nhau vào quả chanh và không để chúng chạm vào nhau, hai đầu còn lại gắn với vôn kế.
B. Cắm hai thanh kim loại khác nhau vào cốc nước muối, hai đầu còn lại gắn với vôn kế.
C. Cắm hai thanh kim loại khác nhau vào cố nước đường, hai đầu còn lại gắn với vôn kế.
D. Cắm hại thanh kim loại khác nhau vào cốc nước cât, hai đầu còn lại gắn với vôn kế.
A. đúng
B. đúng
Câu 7. Nhận định các phát biểu sau
A. Thế điện cực chuẩn càng lớn, tính oxi hoá càng mạnh.
B. Thế điện cực chuẩn càng bé, tính khử càng mạnh.
C. Cặp oxi hoá - khử có giá trị thế điện cực chuẩn lớn đóng vai trò cathode.
D. Cặp oxi hoá – khử có giá trị thế điện cực chuẩn nhỏ hơn đóng vai trò anode
A. đúng
B. đúng
C. đúng
D. đúng
Câu 8. Khi pin điện hoá hoạt động
A. Quá trình khử xảy ra tại cực âm.
B. Quá trình oxi hoá xảy ra tại cực dương.
C. Dòng electron chuyển từ cực âm sang cực dương.
D. Không phát sinh dòng điện
C. đúng
Câu 9. Giá trị hiệu điện thế giữa hai điện cực được xác định
A. Epin = E+ - E-
B. Epin = E- - E+
C. Epin = E+ + E-
D. Epin = điện cực có giá trị thế điện cực chuẩn lớn hơn - điện cực có giá trị thế điện cực chuẩn nhỏ hơn
A. đúng
D. đúng
Câu 10. Cho thế điện cực chuẩn của các cặp oxi hoá - khử Cu2+/Cu = 0,34V ; Fe2+/Fe = - 0,44V ; Fe3+/Fe2+ = 0,77V; Ag+/Ag = 0,8V
Nhận định chiều phản ứng xảy ra
A. Cu2+ + Fe → Cu + Fe2+
B. Fe + Fe3+ → Fe2+
C. Ag+ + Fe2+ → Ag + Fe3+
D. Cu + Fe3+ → Cu2+ + Fe2+
B. đúng
C. đúng
D. đúng
Phần 2. Trắc nghiệm Trả lời ngắn
Câu 1. Cho pin điện hoá Zn2+/Zn và Cu2+/ Cu
Cho E0Cu2+/Cu = 0,34V; E0Zn2+/Zn = - 0,76V . Tính sức điện động chuẩn của pin.
Đáp án:
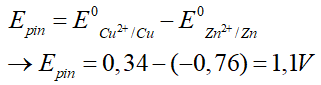
Câu 2. Sức điện động chuẩn của pin Cu2+/ Cu và Ag+/ Ag là Epin = 0,46V; Biết E0Cu2+/Cu = 0,34V
Xác định thế điện cực chuẩn của cặp oxi hoá – khử Ag+/ Ag.
Đáp án:
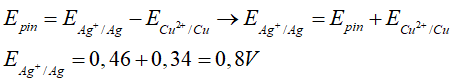
Câu 3. Biết phản ứng oxi hóa khử xảy ra trong một pin điện hóa là:
Fe + Ni2+ → Fe2+ + Ni
Tính suất điện động chuẩn pin điện hóa.
Đáp án:
Phản ứng trên các điện cực:
Cực (-): Fe → Fe2+ + 2e
Cực (+): Ni2+ + 2e → Ni
E0pin = -0,23 - (-0,44) = 0,21 V
Câu 4. Tính thế điện cực chuẩn E0 của cặp oxi hóa khử E0(Cr3+/Cr), biết suất điện động chuẩn của pin điện hóa Cr -Ni là +0,51V và E0(Ni2+/Ni) = -0,23V.
Đáp án:
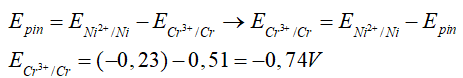
Câu 5. Tính thế điện cực chuẩn E0 của cặp oxi hóa khử E0 (Mn2+/Mn), biết suất điện động chuẩn của pin điện hóa Cd -Mn là +0,79V và E0 (Cd2+/Cd) = -0,40V.
Đáp án:
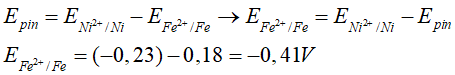
Câu 6. Tính thế điện cực chuẩn E0 của các cặp oxi hóa khử E0( Fe2+/Fe). Biết suất điện động chuẩn của pin điện hóa Fe – Ni là 0,18V thế điện cực chuẩn E0 (Ni2+/Ni) = -0,23V
Đáp án:
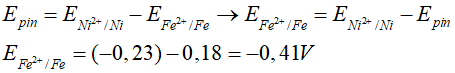
Câu 7. Tính thế điện cực chuẩn E0 của các cặp oxi hóa khử E0( Zn2+/Zn). Biết suất điện động chuẩn của pin điện hóa và của pin Zn – Ag là 1,56V, thế điện cực chuẩn E0 (Ag+/Ag) = 0,8V.
Đáp án:
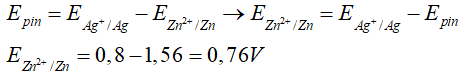
Câu 8. Cho enthalpy tạo thành chuẩn của các chất tương ứng trong phương trình.
| Chất | N2O4 (g) | NO2 (g) |
| (kJ/mol) | 9,16 | 33,20 |
Tính biến thiên enthalpy (kJ)của phản ứng sau (làm tròn đến chữ số thập phân thứ nhất)
2NO (g) → N2O4(g)
Đáp án:
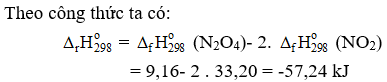
Câu 9. Tính biến thiên enthalpy chuẩn của phản ứng
H2(g) + Cl2(g) → 2HCl(g)
biết Eb (H-H) = 436 kJ/mol, Eb (Cl-Cl) = 243 kJ/mol, Eb (H-Cl) = 432 kJ/mol.
Làm tròn đến chữ số thập phân thứ nhất.
Đáp án:
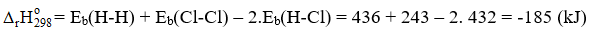
Câu 10. Tính cho phản ứng sau dựa theo năng lượng liên kết (làm tròn đến chữ số thập phân thứ nhất).
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
Biết
| Liên kết | Cl – Cl | C – H | C – Cl | H – Cl |
| Eb(kJ/mol) | 243 | 414 | 339 | 431 |
Đáp án: