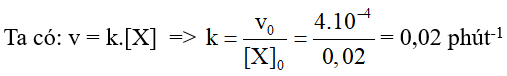Trắc nghiệm Đúng sai Trả lời ngắn Hóa 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Tổng hợp 20 câu Trắc nghiệm Đúng sai Trả lời ngắn Hóa 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng có đáp án chi tiết bám sát chương trình học Sách mới năm học 2024-2025
Phần 1. Trắc nghiệm Đúng Sai
Câu 1. Cho phản ứng hóa học tổng quát: a A + b B → c C + d D (*) có tốc độ phản ứng là v.
A. Giá trị của v phụ thuộc vào nồng độ của chất C hoặc D.
B. Giá trị của v phụ thuộc vào nồng độ của chất A hoặc B.
C. Sau một đơn vị thời gian, nồng độ của chất A giảm xuống.
D. Tốc độ tiêu hao của chất A luôn bằng tốc độ tạo thành của chất C.
B. đúng
C. đúng
Câu 2. Cho phản ứng hóa học tổng quát: a A + b B → c C + d D (*) có tốc độ tức thời của phản ứng là v và k là hằng số tốc độ phản ứng, CA, CB, CC, CD là nồng độ mol của chất A, B, C, D tại thời điểm đang xét.
A. Biểu thức tính tốc độ tức thời của phản ứng (*) là
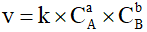
B. k được gọi là tốc độ riêng khi nồng độ của các chất phản ứng bằng đơn vị (1 M).
C. Biểu thức tốc độ tức thời của phản ứng (*) là
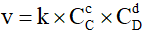
D. Hằng số k phụ thuộc vào bản chất của chất phản ứng, nhiệt độ và thời gian phản ứng.
A. đúng
B. đúng
Câu 3. Xét phản ứng hóa học: X(g) + 3Y(g) → 2Q(g).
A. Tốc độ tiêu hao chất Y bằng 3/2 tốc độ tạo thành chất Q.
B. Tốc độ tiêu hao chất Y bằng 1/3 tốc độ tạo thành chất Q.
C. Tốc độ tạo thành chất Q bằng 2 lần tốc độ tiêu hao chất X.
D. Tốc độ tiêu hao chất X bằng 1/3 tốc độ tiêu hao chất Y.
A. đúng
C. đúng
D. đúng
Câu 4. Cho phản ứng sau: 2NO(g) + O2(g) → 2NO2(g) (*)
A. Tốc độ tiêu thụ của NO nhỏ hơn tốc độ tiêu thụ của O2.
B. Biểu thức tốc độ phản ứng (*) là
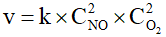
C. Khi tăng nhiệt độ phản ứng thì giá trị hằng số k của phản ứng (*) không thay đổi.
D. Khi tăng nồng độ của NO thì tốc độ phản ứng (*) tăng.
D. đúng
Câu 5. Cho phản ứng hóa học tổng quát: a A + b B → c C + d D (*) có tốc độ trung bình của phản ứng là v ; C1, C2 là nồng độ của một chất tại hai thời điểm tương ứng với thời gian t1, t2.
A. Biểu thức tốc độ trung bình của phản ứng (*) theo chất A là
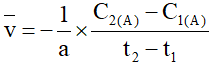
B. Biểu thức tốc độ trung bình của phản ứng (*) theo chất C là
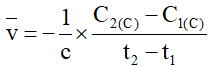
C. Đơn vị của tốc độ trung bình của phản ứng (*) là mol.L-1.(thời gian)-1.
D. Biểu thức liên hệ giữa tốc độ trung bình của phản ứng (*) với tốc độ tạo thành của chất D là
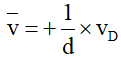
A. đúng
C. đúng
D. đúng
Câu 6. Xét phản ứng:
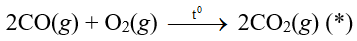
A. Biểu thức tốc độ tức thời của phản ứng (*) viết theo định luật tác dụng khối lượng là
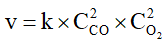
B. Biểu thức tốc độ tức thời của phản ứng (*) viết theo định luật tác dụng khối lượng là
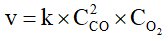
C. Biểu thức liên hệ giữa tốc độ trung bình của phản ứng (*) với tốc độ của CO2 là
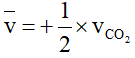
D. Biểu thức liên hệ giữa tốc độ tạo thành CO2 và tốc độ tiêu hao O2 là vCO2 = 2vO2
B. đúng
C. đúng
D. đúng
Câu 7. Cho phương trình hóa học:
2KMnO4(aq) + 10FeSO4(aq) + 8H2SO4(aq) → 5Fe2(SO4)3(aq) + K2SO4(aq) + 2MnSO4(aq) + 8H2O(l)
A. Với cùng một khối lượng các chất tham gia phản ứng, chất phản ứng hết nhanh nhất là KMnO4.
B. Với cùng một khối lượng các chất tham gia phản ứng, chất phản ứng hết nhanh nhất là FeSO4.
C. Với cùng một khối lượng các chất tham gia phản ứng, chất phản ứng hết chậm nhất là H2SO4.
D. Cả 3 chất KMnO4, FeSO4 và H2SO4 phản ứng hết cùng lúc.
B. đúng
Câu 8. Cho phản ứng sau diễn ra tại 250C: A + 3B → 2C + D (*). Biết tốc độ đầu của phản ứng ở các nồng độ đầu khác nhau như sau:
Thí nghiệm |
Nồng độ ban đầu của A (mol L-1) |
Nồng độ ban đầu của B (mol L-1) |
Tốc độ ban đầu của phản ứng vo (mol L-1 s-1) |
|---|---|---|---|
1 |
0,1 |
0,1 |
6.10-4 |
2 |
0,2 |
0,2 |
2,4. 10-3 |
3 |
0,2 |
0,3 |
3,6.10-3 |
A. Biểu thức tốc độ tức thời của phản ứng (*) là
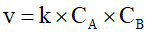
B. Biểu thức tốc độ tức thời của phản ứng (*) là
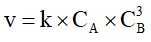
C. Khi nồng độ chất A giảm 2 lần và giữ nguyên nồng độ chất B thì tốc độ phản ứng giảm 2 lần.
D. Khi nồng độ chất B tăng 2 lần và giữ nguyên nồng độ chất A thì tốc độ phản ứng tăng 2 lần.
A. đúng
D. đúng
Câu 9. Phản ứng ion xảy ra khi cho KI tác dụng với anion peroxodisulfate:
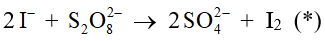
Khi khảo sát động học phản ứng (*) ở 25oC nhận được kết quả sự phụ thuộc giữa tốc độ đầu vo vào nồng độ đầu chất phản ứng Co ở bảng số liệu sau.
A. Biểu thức tốc độ tức thời của phản ứng (*) là
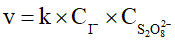
B. Biểu thức tốc độ tức thời của phản ứng (*) là
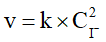
C. Khi nồng độ ion I- tăng 2 lần và giữ nguyên nồng độ ion 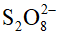 thì tốc độ phản ứng tăng 2 lần.
thì tốc độ phản ứng tăng 2 lần.
D. Khi nồng độ ion 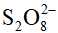 tăng 2 lần và giữ nguyên nồng độ ion I- thì tốc độ phản ứng tăng 2 lần.
tăng 2 lần và giữ nguyên nồng độ ion I- thì tốc độ phản ứng tăng 2 lần.
A. đúng
C. đúng
D. đúng
Câu 10. Cho phản ứng đơn giản xảy ra trong bình kín: 2NO(g) + O2(g) → 2NO2(g) (*).
A. Biểu thức tốc độ tức thời của phản ứng (*) là
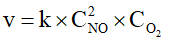
B. Ở nhiệt độ không đổi, khi nồng độ O2 tăng 3 lần, nồng độ NO không đổi thì tốc độ phản ứng tăng 3 lần
C. Ở nhiệt độ không đổi, khi nồng độ NO tăng 3 lần, nồng độ O2 không đổi thì tốc độ phản ứng tăng 9 lần
D. Ở nhiệt độ không đổi, khi nồng độ NO và O2 đều tăng 3 lần thì tốc độ phản ứng tăng 9 lần
A. đúng
B. đúng
C. đúng
Phần 2. Câu hỏi Trả lời ngắn
Câu 1. Cho chất xúc tác MnO2 vào 100 mL dung dịch H2O2, sau 60 giây thu được 0,0015 mol khí O2. Tính tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây.
Đáp án: 5.0,10-4 M/s
H2O2 → H2O + ½O2
0,0015 mol
Số mol H2O2 = 2 x 0,0015 = 0,003 mol.
Nồng độ mol của H2O2 phản ứng: 0,003/0,1 = 0,03 (M)
Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây:
0,03/60 = 5.0.10-4 (M/s)
Câu 2. Xét phản ứng: 2NO + O2 → 2NO2 có hằng số tốc độ được biểu diễn: v = k.[NO]2[O2] . Nếu nồng độ NO tăng lên 4 lần trong khi nồng độ O2 và nhiệt độ được giữ nguyên, thì tốc độ của phản ứng thay đổi tăng bao nhiêu lần.
Đáp án: 16 lần
v = k. (4[NO])2[O2]
Khi nồng độ NO tăng lên 4 lần => v’ = k. (4[NO])2[O2] = 16.v => tốc độ tăng 16 lần.
Câu 3. Để trung hoà hoàn toàn 50 mL dung dịch KOH nồng độ 1,0 mol/L bằng 50,0 mL dung dịch H2SO4 0,5 mol/L cần 0,75 giây. Tính tốc độ trung bình của phản ứng: 2KOH + H2SO4 → K2SO4 + 2H2O.
Đáp án: 0,033 mol.L-1.giây-1
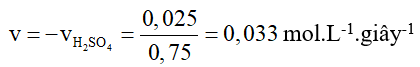
Câu 4. Sulfuric acid (H2SO4) là hóa chất quan trọng trong công nghiệp, ứng dụng trong sản xuất phân bón, lọc dầu, xử lí nước thải, … Một giai đoạn để sản xuất H2SO4 là phản ứng sau:
2SO2(g) + O2(g) → 2SO3(g)
Tại thời gian 300 giây thì nồng độ của SO2 và SO3 đo được lần lượt là 0,0270 mol/L và 0,0072 mol/L. Vậy nếu tại 720 giây, nồng độ của SO2 đo được là 0,0194 mol/L thì nồng độ của SO3 là bao nhiêu?
Đáp án: 0,0148 M

Câu 5. Phương trình tổng hợp ammonia (NH3): N2(g) + 3H2(g) → 2NH3(g). Nếu tốc độ tạo thành NH3 là 0,345 M/s thì tốc độ tiêu hao của chất phản ứng H2 là bao nhiêu?
Đáp án: 0,518 M/s
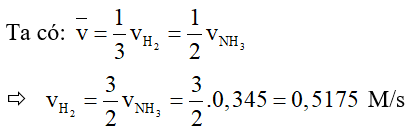
Câu 6. Phản ứng ion xảy ra khi cho KI tác dụng với anion peroxodisulfate:
2I- + S2O82- → 2SO42- + I2 (*)
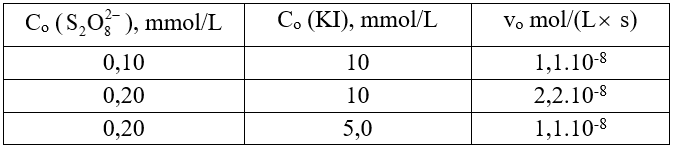
Khi khảo sát động học phản ứng (*) ở 25oC nhận được kết quả sự phụ thuộc giữa tốc độ đầu vo vào nồng độ đầu chất phản ứng Co ở bảng số liệu sau.
Thí nghiệm |
Co (S2O82-), mmol/L |
Co (KI), mmol/L |
vo mol/(L.s) |
|---|---|---|---|
1 |
0,10 |
10 |
1,1.10-8 |
2 |
0,20 |
10 |
2,2.10-8 |
3 |
0,20 |
5,0 |
1,1.10-8 |
Tính hằng số tốc độ phản ứng ở 25oC theo đơn vị mol/(L.s).
Đáp án: 0,011 mol/(L.s)
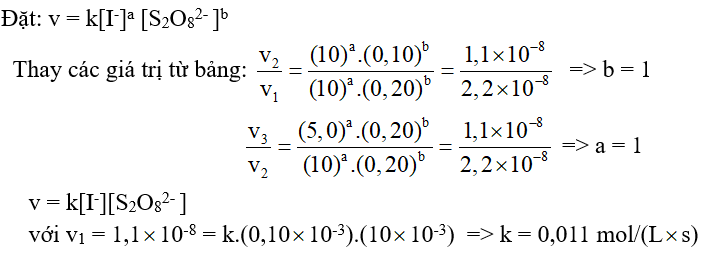
Câu 7. Cho phản ứng tert – butyl chloride (tert-C4H9Cl) với nước:
C4H9Cl(l) + H2O(l) → C4H9OH(aq) + HCl(aq)
Tính tốc độ trung bình của phản ứng theo tert-butyl chloride, với nồng độ ban đầu là 0,22 M, sau 4 giây, nồng độ còn lại 0,10M.
Đáp án: 0,03 M/s
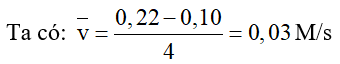
Câu 8. Xét phản ứng hóa học đơn giản giữa hai chất A và B theo phương trình: A + B → C.
Từ thông tin đã cho, hoàn thành bảng dưới đây:
Thực nghiệm Nồng độ chất A (M) Nồng độ chất B (M) Tốc độ phản ứng (M/giây)
Thực nghiệm |
Nồng độ chất A (M) |
Nồng độ chất B (M) |
Tốc độ phản ứng (M/giây) |
|---|---|---|---|
1 |
0,20 |
0,050 |
0,24 |
2 |
a |
0,030 |
0,20 |
3 |
0,40 |
b |
0,80 |
Tính giá trị của a và b.
Đáp án: a = 0,278; b = 0,083
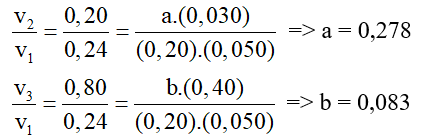
Câu 9. Xét phản ứng phân hủy N2O5 trong dung môi CCl4 ở 450C: N2O5 → N2O4 + ½O2
Ban đầu nồng độ của N2O5 là 2,33M, sau 184 giây nồng độ của N2O5 là 2,08M. Tính tốc độ trung bình của phản ứng tính theo N2O5.
Đáp án: 1,36.10-3 mol/(L.s)
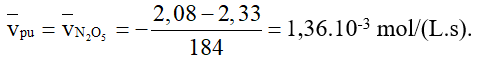
Câu 10. Một phản ứng pha khí xảy ra theo phương trình: X(g) → Y(g) (1).
Khi nồng độ đầu [X]0 = 0,02 mol.L-1 thì tốc độ đầu của phản ứng v0 (ở 25oC) là 4.10-4 mol.L-1.phút-1; định luật tốc độ của phản ứng có dạng: v = k.[X] (2), trong đó k là hằng số tốc độ của phản ứng. Tính giá trị của k.
Đáp án: 0,02 phút-1