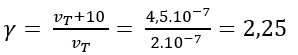Trắc nghiệm Đúng sai Trả lời ngắn Hóa 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hoá học
Tổng hợp 20 câu Trắc nghiệm Đúng sai Trả lời ngắn Hóa 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hoá học có đáp án chi tiết bám sát chương trình học Sách mới năm học 2024-2025
Phần 1. Trắc nghiệm Đúng Sai
Câu 1. Cho a g kim loại Zn dạng hạt vào lượng dư dung dịch HCl 2M, phương trình hóa học xảy ra như sau:
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
A. Thay a g Zn hạt bằng a g bột Zn làm giảm diện tích tiếp xúc của chất phản ứng .
B. Thay a g Zn hạt bằng a g bột Zn làm tốc độ khí H2 thoát ra nhanh hơn.
C. Thay dung dịch HCl 2M bằng dung dịch HCl 1M làm tốc độ khí H2 thoát ra chậm hơn.
D. Thực hiện phản ứng bằng cách đun nóng nhẹ dung dịch HCl làm tốc độ khí H2 thoát ra nhanh hơn.
B. đúng
D. đúng
Câu 2. Thực hiện 2 phản ứng sau (ở cùng nhiệt độ):
(1) Zn (bột) + dung dịch CuSO4 1M
(2) Zn (hạt) + dung dịch CuSO4 1M
A. Kết quả thu được tốc độ phản ứng (1) và phản ứng (2) là như nhau.
B. Kết quả thu được tốc độ phản ứng (1) nhanh hơn phản ứng (2).
C. Kết quả thu được tốc độ phản ứng (1) chậm hơn phản ứng (2).
D. Không thể so sánh được tốc độ của 2 phản ứng.
B. đúng
Câu 3. Cho phản ứng: Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
A. Khi tăng nồng độ dung dịch HCl thì số lần va chạm giữa các chất phản ứng sẽ giảm, tốc độ phản ứng tạo ra sản phẩm tăng.
B. Khi tăng nồng độ dung dịch HCl thì số lần va chạm giữa các chất phản ứng sẽ giảm, tốc độ phản ứng tạo ra sản phẩm giảm.
C. Khi tăng nồng độ dung dịch HCl thì số lần va chạm giữa các chất phản ứng sẽ tăng, tốc độ phản ứng tạo ra sản phẩm tăng.
D. Khi tăng nồng độ dung dịch HCl thì số lần va chạm giữa các chất phản ứng sẽ tăng, tốc độ phản ứng tạo ra sản phẩm giảm.
C. đúng
Câu 4. Cho hiện tượng sau: Tàn đóm đỏ bùng lên khi cho vào bình oxygen nguyên chất. Hiện tượng trên thể hiện ảnh hưởng của yếu tố nào đến tốc độ phản ứng?
A. Hiện tượng trên thể hiện ảnh hưởng của nồng độ đến tốc độ phản ứng.
B. Hiện tượng trên thể hiện ảnh hưởng của nhiệt độ đến tốc độ phản ứng.
C. Hiện tượng trên thể hiện ảnh hưởng của diện tích bề mặt tiếp xúc đến tốc độ phản ứng.
D. Hiện tượng trên thể hiện ảnh hưởng của chất xúc tác đến tốc độ phản ứng.
A. đúng
Câu 5. Quá trình nung hỗn hợp bột đá vôi, đất sét và thạch cao ở nhiệt độ cao để sản xuất clinke trong công nghiệp sản xuất xi măng.
A. Người ta vận dụng yếu tố nồng độ để tăng tốc độ phản ứng.
B. Người ta vận dụng yếu tố nhiệt độ để tăng tốc độ phản ứng.
C. Người ta vận dụng yếu tố áp suất để tăng tốc độ phản ứng.
D. Người ta dùng chất xúc tác để tăng tốc độ phản ứng.
B. đúng
Câu 6. Cho phản ứng:
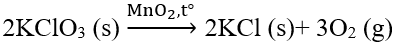
A. Yếu tố không ảnh hưởng đến tốc độ của phản ứng trên là nhiệt độ.
B. Yếu tố không ảnh hưởng đến tốc độ của phản ứng trên là chất xúc tác.
C. Yếu tố không ảnh hưởng đến tốc độ của phản ứng trên là áp suất.
D. Yếu tố không ảnh hưởng đến tốc độ của phản ứng trên là kích thước các tinh thể KClO3.
C. đúng
Câu 7. Khi tăng nhiệt độ của một hệ phản ứng sẽ dẫn đến sự va chạm có hiệu quả giữa các phân tử chất phản ứng.
A. Tính chất của sự va chạm đó là thoạt đầu tăng, sau đó giảm dần.
B. Tính chất của sự va chạm đó là chỉ có giảm dần.
C. Tính chất của sự va chạm đó là thoạt đầu giảm, sau đó tăng dần.
D. Tính chất của sự va chạm đó là chỉ có tăng dần.
A. đúng
Câu 8. Nghiên cứu ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Chuẩn bị: 2 bình tam giác, dung dịch HCl 0,5 M, đá vôi dạng viên, đá vôi đập nhỏ.
Tiến hành:
- Cho cùng một lượng (khoảng 2 g) đá vôi dạng viên vào bình tam giác (1) và đá vôi đập nhỏ vào bình tam giác (2).
- Rót 20 mL dung dịch HCl 0,5 M vào mỗi bình.
Quan sát hiện tượng và trả lời câu hỏi:
A. Phản ứng trong bình (1) có tốc độ thoát khí nhanh hơn.
B. Phản ứng trong bình (2) có tốc độ thoát khí nhanh hơn.
C. Đá vôi đập nhỏ có tổng diện tích bề mặt lớn hơn.
D. Đá vôi dạng viên có tổng diện tích bề mặt lớn hơn.
B. đúng
C. đúng
Câu 9. Nghiên cứu ảnh hưởng của nồng độ đến tốc độ phản ứng:
Na2S2O3 + H2SO4 → Na2SO4 + S + SO2 + H2O
Chuẩn bị: Các dung dịch: Na2S2O3 0,05 M, Na2S2O3 0,10 M, Na2S2O3 0,30 M, H2SO4 0,5 M; 3 bình tam giác, đồng hồ bấm giờ, tờ giấy trắng có kẻ chữ X.
Tiến hành:
- Cho vào mỗi bình tam giác 30 mL dung dịch Na2S2O3 với các nồng độ tương ứng là 0,05 M; 0,10 M và 0,30 M. Đặt các bình lên tờ giấy trắng có kẻ sẵn chữ X.
- Rót nhanh vào mỗi bình 30 mL dung dịch H2SO4 0,5 M và bắt đầu bấm giờ.
Lưu ý: Phản ứng có sinh ra khí độc. Cần tiến hành cẩn thận và tránh ngửi trực tiếp trên miệng bình tam giác.

Quan sát vạch chữ X trên tờ giấy dưới đáy bình, ghi lại thời điểm không nhìn thấy vạch chữ X nữa và trả lời câu hỏi:
A. Phản ứng ở bình chứa dung dịch Na2S2O3 có nồng độ 0,3M xảy ra nhanh nhất.
B. Phản ứng ở bình chứa dung dịch Na2S2O3 có nồng độ 0,05M xảy ra chậm nhất.
C. Khi nồng độ các chất tham gia tăng, tốc độ phản ứng sẽ giảm.
D. Khi nồng độ các chất tham gia tăng, tốc độ phản ứng sẽ tăng.
A. đúng
B. đúng
D. đúng
Câu 10. Xét các phản ứng xảy ra trong bình kín theo phương trình hoá học:
2CO(g) + O2(g)→2CO2(g) (1)
NH4Cl(s)→NH3(g) + HCl(g) (2)
A. Yếu tố áp suất ảnh hưởng đến tốc độ của phản ứng (1).
B. Yếu tố áp suất làm giảm tốc độ của phản ứng (1).
C. Yếu tố áp suất không ảnh hưởng đến tốc độ của phản ứng (2).
D. Yếu tố áp suất làm tăng tốc độ của phản ứng (2).
A. đúng
C. đúng
Phần 2. Câu hỏi Trả lời ngắn
Câu 1. Cho phương trình hóa học phản ứng: 2NO(g) + O2(g) → 2NO2(g). Khi tăng nồng độ NO lên 2 lần thì tốc độ phản ứng tăng lên mấy lần ?
Đáp án: 4
Ta có: v = k.[NO]2.[O2]
v' = k.[2NO]2.[O2] = 4.k.[NO]2.[O2] = 4v
Câu 2. Cho phương trình hóa học phản ứng: 2SO2(g) + O2(g) → 2SO3(l). Tốc độ phản ứng giảm đi 3 lần khi giảm nồng độ O2 mấy lần?
Đáp án: 1/3
Ta có: v = k.[SO2]2.[O2]
v' = k.[SO2]2.[1/3.O2] = 1/3.k.[NO]2.[O2] = 1/3v
Câu 3. Cho phản ứng: A(g) + 2B(g) → C(g) + D(g). Khi tăng nồng độ chất B thêm 3 lần và giữ nguyên nồng độ chất A thì tốc độ phản ứng tăng bao nhiêu lần?
Đáp án: 9
Ta có: v = k[A].[B]2
v' = k[A].[3B]2 = 9.k[A].[B]2 = 9.v
Vậy khi tăng nồng độ chất B thêm 3 lần và giữ nguyên nồng độ chất A thì tốc độ phản ứng tăng 9 lần.
Câu 4. Cho phản ứng: A + 2B → C. Nồng độ ban đầu của A là 0,8 mol/L, của B là 1 mol/L Sau 10 phút, nồng độ của B còn 0,6 mol/L. Nồng độ của A còn lại là bao nhiêu mol/L?
Đáp án: 0,6 mol/L
Khi [B] còn 0,6 mol/L tức [B] giảm 0,4 mol/L.
Theo phương trình hoá học của phản ứng [A] giảm 0,2 mol/L.
Nghĩa là [A] còn lại 0,8 – 0,2 = 0,6 mol/L
Câu 5. Cho phản ứng A + 2B → C. Nồng độ ban đầu của A là 1M, B là 3M, hằng số tốc độ k=0,5. Vận tốc của phản ứng khi đã có 20% chất A tham gia phản ứng là bao nhiêu?
Đáp án: 2,704 (mol/L.s)
Khi đó:
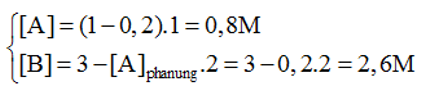
Tốc độ phản ứng lúc đó là v = k[A].[B]2=0,5.0,8.[2,6]2 =2,704 (mol/L.s).
Câu 6. Cho phản ứng: 2A + B → C. Nồng độ ban đầu của A là 6M, của B là 4M. Hằng số tốc độ k = 0,5. Tốc độ phản ứng lúc ban đầu là bao nhiêu?
Tốc độ phản ứng lúc đầu là v = k[A]2.[B] = 0,5.62.4 = 72 (mol/L.s)
Đáp án: 72 (mol/L.s)
Tốc độ phản ứng lúc đầu là v = k[A]2.[B] = 0,5.62.4 = 72 (mol/L.s)
Câu 7. Khi nhiệt độ tăng thêm 10oC thì tốc độ phản ứng tăng 3 lần. Khi nhiệt độ tăng từ 20oC lên 80oC thì tốc độ phản ứng tăng lên bao nhiêu lần?
Đáp án: 729
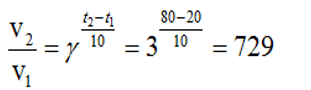
Câu 8. Cho phương trình hoá học của phản ứng: 2CO(g) + O2(g) → 2CO2(g)
Nếu hệ số nhiệt độ Van't Hoff bằng 2, tốc độ phản ứng tăng lên bao nhiêu lần khi tăng nhiệt độ của phản ứng từ 30°C lên 60°C?
Đáp án: 9
Ta có:
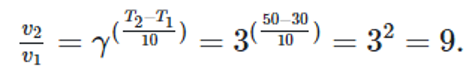
Vậy tốc độ phản ứng tăng 9 lần.
Câu 9. Một phản ứng có hệ số nhiệt độ Van’t Hoff bằng 3,5. Ở 20°C, tốc độ của phản ứng này bằng 0,2 mol/L.s-1. Tốc độ của phản ứng ở 45°C là bao nhiêu?
Đáp án: 4,6 mol/L.s-1
Tốc độ của phản ứng ở 45°C là:
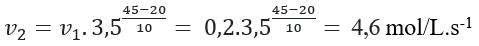
Câu 10. Ở nhiệt độ cao NOCl bị phân hủy theo phản ứng hóa học sau:
2NOCl → 2NO + Cl2
Tốc độ phản ứng ở 70oC là 2.10-7 mol/(L.s) và ở 80oC là 4,5.10-7 mol/(L.s). Hệ số nhiệt độ Van’t Hoff (γ) của phản ứng là bao nhiêu?
Đáp án: 2,25
Hệ số nhiệt độ Van’t Hoff :