Trắc nghiệm Đúng sai Trả lời ngắn Hóa 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Tổng hợp 20 câu Trắc nghiệm Đúng sai Trả lời ngắn Hóa 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học có đáp án chi tiết bám sát chương trình học Sách mới năm học 2024-2025
Phần 1. Trắc nghiệm Đúng Sai
Câu 1. Cho phản ứng sau: CH≡CH(g) + 2H2(g) → CH3 - CH(g) (*)
Biết liên kết trong các phân tử:
CH≡CH có 1 liên kết C≡C, 2 liên kết C-H; CH3 - CH3 có 1 liên kết C-C và 6 liên kết C-H
Cho năng lượng liên kết (kJ/ mol) ở điều kiện chuẩn của các liên kết trong các phân tử:
Liên kết |
H-H |
C≡C |
C-C |
C-H |
|---|---|---|---|---|
Năng lượng liên kết (kJ/mol) |
436 |
839 |
347 |
414 |
A. Công thức tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết là
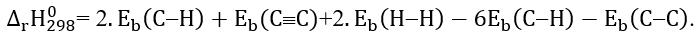
B. Liên kết C-C bền hơn liên kết C≡C.
C. Biến thiên enthalpy chuẩn của phản ứng (*) là - 292 kJ.
D. Phân tử CH≡CH có 2 liên kết σ và 2 liên kết π.
A. đúng
C. đúng
Câu 2. Cho phản ứng sau: 2H2(g) + O2(g) → 2H2O(g) 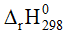 = -483,64kJ
= -483,64kJ
Phát biểu nào sau đây đúng:
A. Enthalpy tạo thành chuẩn của H2O (g) là - 241,82 kJ/mol.
B. Phản ứng trên diễn ra không thuận lợi.
C. Phản ứng đã hấp thụ 483,64 kJ.
D. Công thức tính  của phản ứng dựa vào enthalpy tạo thành là
của phản ứng dựa vào enthalpy tạo thành là
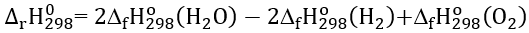
A. đúng
Câu 3. Cho sơ đồ sau:
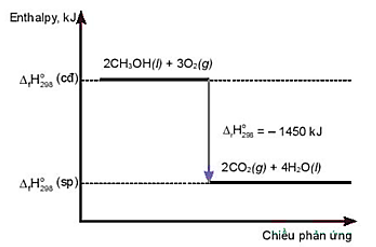
A. Phương trình nhiệt hoá học của phản ứng là: 2CH3OH(l) + 3O2(g) → 2CO2(g) + 4H2O(l).
B. Công thức tính biến thiên enthalpy của phản ứng dựa vào enthalpy tạo thành là:
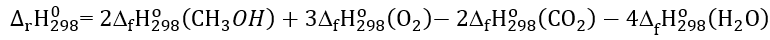
C. Nhiệt lượng toả ra của phản ứng là 1450 kJ.
D. Sau phản ứng, sản phẩm có mức năng lượng cao hơn chất ban đầu.
C. đúng
Câu 4. Cho phương trình hóa học:
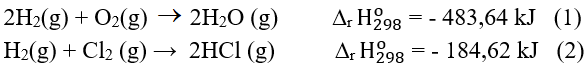
A. Enthalpy tạo thành chuẩn của HCl (g) là – 92,31 kJ/mol.
B. Biến thiên enthalpy chuẩn của phản ứng (2) là 184,62 kJ.
C. Enthalpy tạo thành chuẩn của H2O (g) là - 483,64 kJ/mol.
D. Phản ứng (1) tỏa nhiều nhiệt hơn phản ứng (2).
A. đúng
D. đúng
Câu 5. Biến thiên enthalpy chuẩn của phản ứng tổng hợp amonia:
N2(g) + 3H2(g) → 2NH3(g)
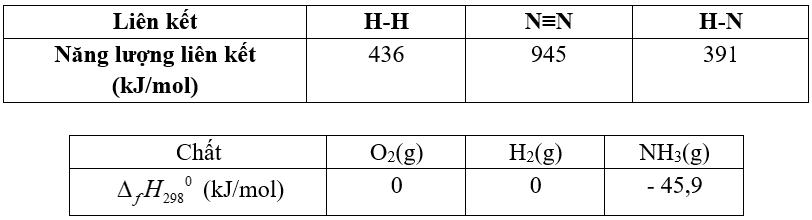
A. Công thức tính biến thiên enthalpy của phản ứng dựa vào enthalpy tạo thành là:
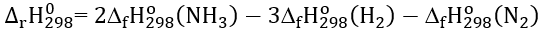
B. Công thức tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết là:
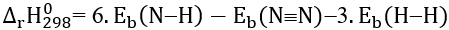
C. Biến thiên enthalpy của phản ứng trên tính theo năng lượng liên kết và tính theo enthalpy tạo thành có kết quả giống nhau.
D. Phản ứng trên là phản ứng tỏa nhiệt nên dễ dàng xảy ra ở điều kiện chuẩn.
A. đúng
Câu 6. Cho phản ứng sau: S(s) + O2(g) → SO2(g) 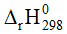 = −296,8 kJ.
= −296,8 kJ.
A. Nhiệt kèm theo phản ứng tạo thành 1 mol chất từ các đơn chất bền được gọi là nhiệt tạo thành (enthalpy tạo thành).
B. 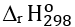 = −296,8 kJ/mol là lượng nhiệt tỏa ra khi tạo ra 1 mol SO2(g) từ đơn chất S(s) và O2(g). Đây là các đơn chất bền nhất ở điều kiện chuẩn.
= −296,8 kJ/mol là lượng nhiệt tỏa ra khi tạo ra 1 mol SO2(g) từ đơn chất S(s) và O2(g). Đây là các đơn chất bền nhất ở điều kiện chuẩn.
C. S(s) + O2(g) → SO2(g) 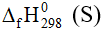 = –296,80 kJ/mol, kết luận: hợp chất SO2(g) bền hơn về mặt năng lượng so với các đơn chất bền S(s) và O2(g).
= –296,80 kJ/mol, kết luận: hợp chất SO2(g) bền hơn về mặt năng lượng so với các đơn chất bền S(s) và O2(g).
D. Ở điều kiện chuẩn 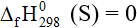 .
.
A. đúng
B. đúng
C. đúng
D. đúng
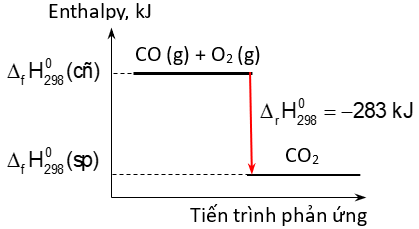
Câu 7. Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới đây.
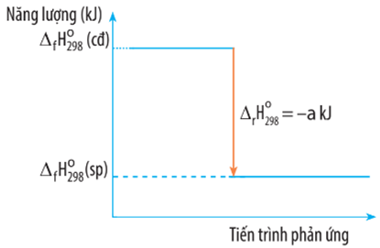
A. Phản ứng tỏa nhiệt.
B. Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng sản phẩm.
C. Biến thiên enthalpy của phản ứng là a kJ/mol.
D. Giá trị nhiệt độ và áp suất được chọn ở điều kiện chuẩn là 298 K và 1 bar.
A. đúng
D. đúng
Câu 8. Cho các phương trình nhiệt hóa học sau:
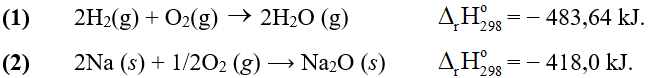
A. Nhiệt tạo thành chuẩn của H2O (g) và Na2O (s) lần lượt là -483,64 kJ/mol và − 418,0 kJ/mol.
B. Xét phản ứng (2), Nếu chỉ có 0,4 mol Na(s) tham gia phản ứng ở điều kiện chuẩn thì lượng nhiệt tỏa ra là 83,6 kJ.
C. Xét phản ứng (1), nước có năng lượng lớn hơn hỗn hợp của oxygen và hydrogen.
D. Sau giai đoạn khơi mào, cả hai phản ứng đều xảy ra mãnh liệt và tỏa nhiều nhiệt.
B. đúng
D. đúng
Câu 9. Cho sơ đồ biễn biến enthalpy của phản ứng:
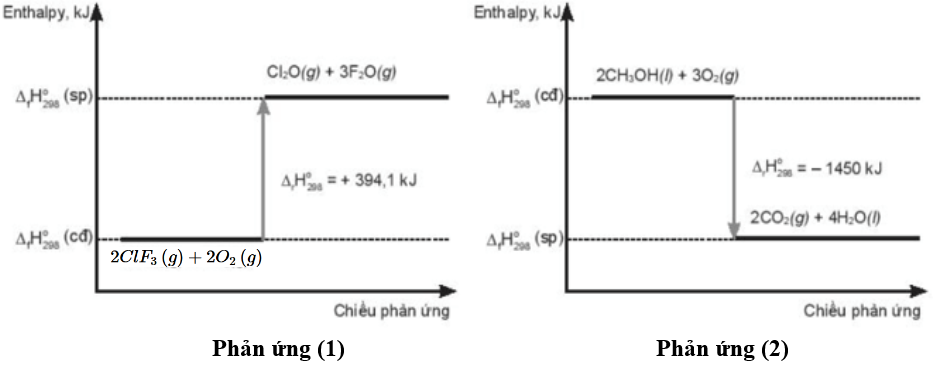
A. Phản ứng (1) và (2) đều là phản ứng cháy nên diễn ra thuận lợi, không cần cung cấp năng lượng.
B. Xét phản ứng (1), sản phẩm có mức năng lượng cao hơn chất ban đầu.
C. Phương trình nhiệt hóa học của phản ứng (1) là
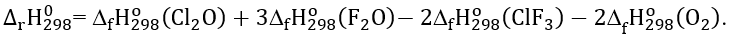
D. Phương trình nhiệt hóa học của phản ứng (2) là
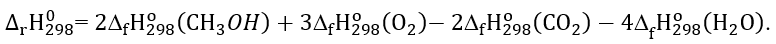
B. đúng
C. đúng
Câu 10. Cho các phản ứng dưới đây:
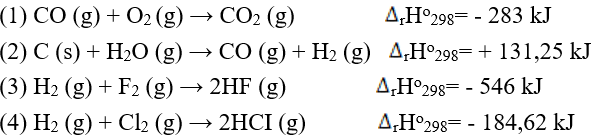
A. Có ba phản ứng tỏa nhiệt.
B. Trong cùng điều kiện, phản ứng (2) diễn ra thuận lợi nhất.
C. Phản ứng (3) dễ xảy ra hơn phản ứng (4).
D. Sơ đồ biễn biến enthalpy của phản ứng (1) là
A. đúng
C. đúng
D. đúng
Phần 2. Câu hỏi Trả lời ngắn
Câu 1. Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
Liên kết |
C–H |
C–C |
C=C |
|---|---|---|---|
Eb (kJ/mol) |
418 |
346 |
612 |
Biến thiên enthalpy của phản ứng: C3H8(g) → CH4(g) + C2H4(g) có giá trị bao nhiêu kJ?
Đáp án: 80
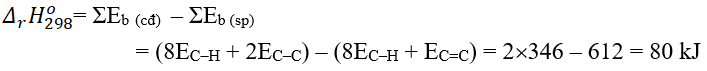
Câu 2. Biết CH3COCH3 có công thức cấu tạo
Phản ứng đốt cháy acetone (CH3COCH3):
CH3COCH3(g) + 4O2(g) → 3CO2(g) + 3H2O(g)
Từ số liệu năng lượng liên kết:
Liên kết |
C – C |
C – H |
O = O |
C = O |
O – H |
|---|---|---|---|---|---|
Eb(kJ/mol) |
346 |
418 |
494 |
732 |
459 |
Tính lượng nhiệt tỏa ra khi đốt cháy 2,9 gam acetone.
Đáp án: 61,9

Lượng nhiệt tỏa ra khi đốt cháy 2,9 gam acetone là
2,9: 58. 1238 = 61,9 kJ
Câu 3. Dựa vào phương trình nhiệt hóa học của phản ứng sau:
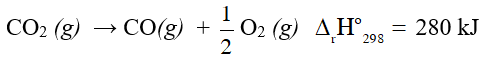
Giá trị 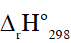 của phản ứng 2CO + O2 (g) → 2CO2 (g) là bao nhiêu kJ?
của phản ứng 2CO + O2 (g) → 2CO2 (g) là bao nhiêu kJ?
Đáp án: -560
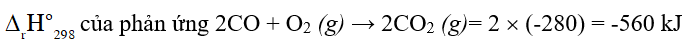
Câu 4. Ở điều kiện chuẩn, nhiệt lượng tỏa ra của phản ứng sau là 1035,88 kJ

Đáp án: -20,7
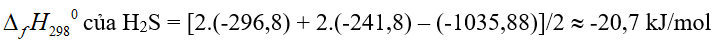
Câu 5. Phản ứng tổng hợp ammonia:

Biết năng lượng liên kết (kJ/mol) của N ≡ N và H - H lần lượt là 946 và 436. Năng lượng liên kết của N – H trong ammonia có giá trị bao nhiêu kJ/mol?
Đáp án: 391
Câu 6. Một mẫu khí gas X chứa hỗn hợp propane và butane.
Cho các phản ứng:
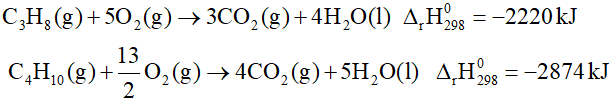
Đốt cháy hoàn toàn 12 gam mẫu khí gas X tỏa ra nhiệt lượng 597,6 kJ. Xác định số mol của butane trong X.
Đáp án: 0,15
Đặt a, b lần lượt là số mol của propane và butane
44a + 58b = 12
A.2220 + B.2874 = 597,6
a = 0,075 mol
b = 0,15 mol
Vậy số mol của butane trong X là 0,15 mol
Câu 7. Cho các phản ứng:
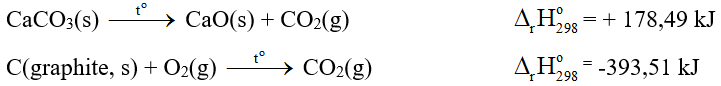
Tính khối lượng graphite (gam) cần dùng khi đốt cháy hoàn toàn đủ tạo lượng nhiệt cho quá trình nhiệt phân hoàn toàn 0,2 mol CaCO3. Giả thiết hiệu suất các quá trình đều là 100%. (kết quả làm tròn đến hàng đơn vị)
Đáp án: 1
Nhiệt phân hoàn toàn 0,2 mol CaCO3 cần lượng nhiệt là
0,2.178,49=35,698 kJ
Khối lượng graphite cần dùng là
35,698:393,51.12 ≈ 1 gam
Câu 8. Bình “ga” sử dụng trong một hộ gia đình có chứa 12 kg khí hóa lỏng (LPG) gồm propan (C3H8) và butan (C4H10) với tỉ lệ mol tương ứng là 2 : 3. Khi được đốt cháy hoàn toàn, 1 mol propan tỏa ra lượng nhiệt là 2220 kJ và 1 mol butan tỏa ra lượng nhiệt là 2850 kJ (sản phẩm gồm H2O ở trạng thái lỏng và khí CO2). Trung bình, lượng nhiệt tiêu thụ từ' đốt khí “ga” của hộ gia đình Y là 10.000 kJ/ngày và hiệu suất sử dụng nhiệt là 67,3%.
Sau bao nhiêu ngày hộ gia đình sẽ sử dụng hết bình ga trên? (kết quả làm tròn đến hàng đơn vị)
Đáp án: 40
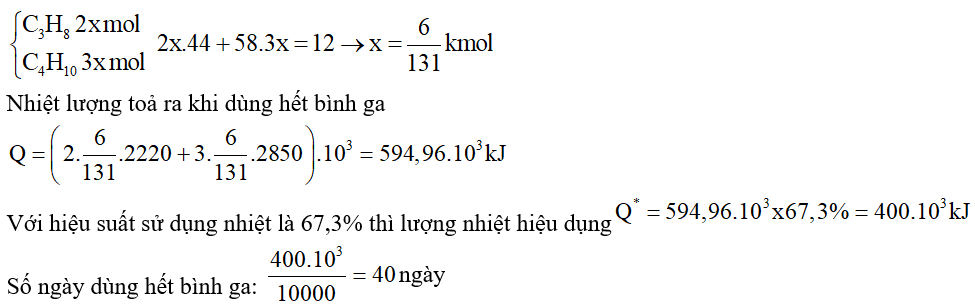
Câu 9. Một hộ gia đình mua than đá làm nhiên liệu đun nấu và trung bình mỗi ngày dùng hết 1,60 kg
than. Giả thiết loại than đá trên chứa 90% carbon về khối lượng, còn lại là các tạp chất trơ.
Cho phản ứng:

Nhiệt lượng cung cấp cho hộ gia đình từ quá trình đốt than trong một ngày tương đương bao nhiêu số điện?
Biết rằng 1 số điện =1 kWh = 3600 kJ. Nguyên tử khối của carbon là 12. (kết quả làm tròn đến hàng đơn vị)
Đáp án: 13
Nhiệt lượng tỏa ra khi đốt than là
Q= 1,6.90%.1000:12.(-393,5)= -47220 kJ
Số điện quy đổi được là
47220:3600 ≈ 13
Câu 10. Cho phản ứng đốt cháy butane sau: C4H10(g) + O2(g) → CO2(g) + H2O(g)
Biết năng lượng liên kết trong các hợp chất cho trong bảng sau:
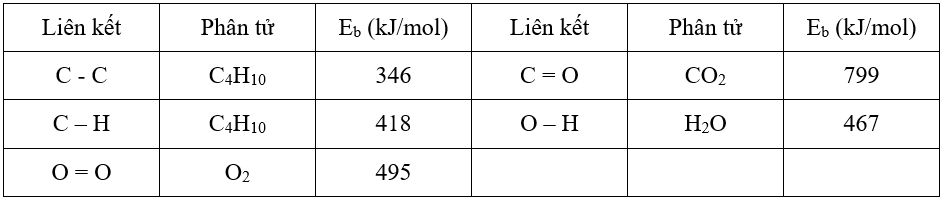
Một bình gas chứa 10 kg butane có thể đun sôi bao nhiêu ấm nước? (Giả thiết mỗi ấm nước chứa 2 L nước ở 25 °C, nhiệt dung của nước là 4,2 J/g.K, có 45% nhiệt đốt cháy butane bị thất thoát ra ngoài môi trường).
Đáp án: 395
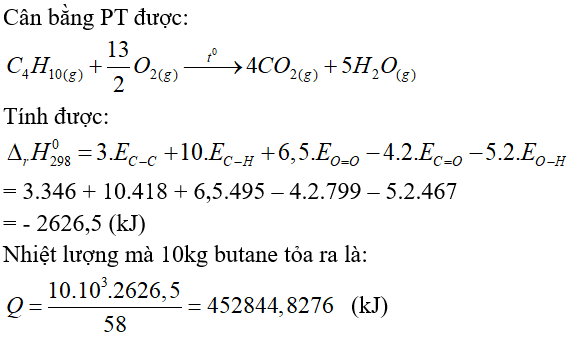
Nhiệt cần đun 1 ấm nước:
2.103.4,2(100-25)=630000 (J) = 630 (kJ)
Số ấm nước:
452844,8276.55%/630 ≈ 395 (ấm nước)
