Trắc nghiệm Đúng sai Trả lời ngắn Hóa 10 Bài 13: Enthalpy tạo thành và biến thiên anthalpy của phản ứng hóa học
Tổng hợp 20 câu Trắc nghiệm Đúng sai Trả lời ngắn Hóa 10 Bài 13: Enthalpy tạo thành và biến thiên anthalpy của phản ứng hóa học có đáp án chi tiết bám sát chương trình học Sách mới năm học 2024-2025
Phần 1. Trắc nghiệm Đúng Sai
Câu 1. Hòa tan 5g CaO vào cốc chịu nhiệt chứa 25 mL nước cất ở nhiệt độ 25oC, sau 2 phút nhiệt độ đo được là 50oC.
A. Phản ứng giữa CaO và nước là phản ứng thu nhiệt.
B. Phản ứng giữa CaO và nước là phản ứng tỏa nhiệt.
C. Tổng enthalpy tạo thành của các chất tham gia phản ứng trên lớn hơn tổng enthalpy của sản phẩm.
D. Biến thiên enthalpy của phản ứng trên nhỏ hơn 0.
B. đúng
C. đúng
D. đúng
Câu 2. Cho phương trình nhiệt hóa sau:
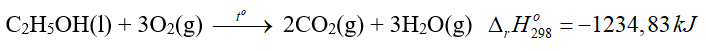
A. Phản ứng trên là phản ứng tỏa nhiệt.
B. Nhiệt tạo thành của O2 bằng 0.
C. Tổng enthalpy tạo thành của các chất tham gia phản ứng trên nhỏ hơn tổng enthalpy của sản phẩm.
D. Để đốt cháy 1 mol chất lỏng C2H5OH cần nhiệt lượng là 1234,83 kJ.
A. đúng
B. đúng
Câu 3. Cho phương trình nhiệt hóa sau:
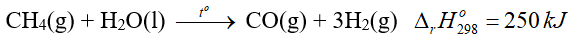
A. Phản ứng trên xảy ra thuận lợi.
B. Phản ứng trên là phản ứng tỏa nhiệt.
C. Nhiệt lượng cần để 1 mol CH4 phản ứng hoàn toàn với 1 mol H2O là 250 kJ.
D. Tổng enthalpy tạo thành của các chất tham gia phản ứng trên nhỏ hơn tổng enthalpy của sản phẩm.
C. đúng
D. đúng
Câu 4. Cho
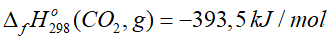
A. CO2 bền hơn về mặt năng lượng so với các đơn chất bền tạo nên nó.
B. CO2 kém bền hơn về mặt năng lượng so với các đơn chất bền tạo nên nó.
C. Khi tạo ra 1 mol khí CO2 từ các đơn chất bền thì nhiệt lượng tỏa ra là 393,5 kJ/mol.
D. Khi tạo ra 1 mol khí CO2 từ các đơn chất bền thì cần cung cấp nhiệt lượng là 393,5 kJ/mol.
A. đúng
C. đúng
Câu 5. Phản ứng nhiệt phân CaCO3:
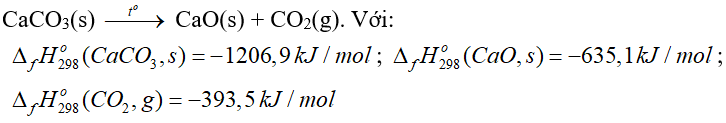
A. Tổng enthalpy tạo thành của chất tham gia phản ứng nhỏ hơn tổng enthalpy của sản phẩm.
B. Tổng enthalpy tạo thành của chất tham gia phản ứng lớn hơn tổng enthalpy của sản phẩm.
C. Nhiệt lượng cần để nhiệt phân 1 mol CaCO3 ở 25oC là 178,3 kJ.
D. Phản ứng trên tỏa nhiệt.
A. đúng
C. đúng
Câu 6. Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:

A. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
B. Phản ứng trên là phản ứng thu nhiệt.
C. Phản ứng trên xảy ra thuận lợi ở điều kiện thường.
D. Phản ứng xảy ra có sự hấp thụ nhiệt của môi trường.
B. đúng
D. đúng
Câu 7. Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ sau:
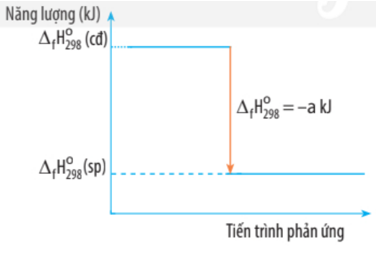
A. Phản ứng trên là phản ứng tỏa nhiệt.
B. Năng lượng chất tham gia phản ứng lớn hơn năng lượng sản phẩm.
C. Biến thiên enthalpy của phản ứng là a kJ.
D. Phản ứng xảy ra có sự hấp thụ nhiệt của môi trường.
A. đúng
B. đúng
Câu 8. Cho hai phương trình nhiệt hóa học sau:
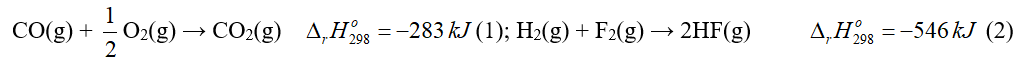
A. Phản ứng (1) xảy ra thuận lợi hơn phản ứng (2)
B. Phản ứng (1) và (2) là phản ứng thu nhiệt
C. Phản ứng (2) xảy ra thuận lợi hơn phản ứng (1)
D. Phản ứng (1) và (2) là phản ứng tỏa nhiệt
C. đúng
D. đúng
Câu 9. Cho phương trình nhiệt hóa học của phản ứng:
2H2(g) + O2(g) → 2H2O(g)
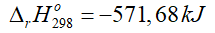
A. Phản ứng trên là phản ứng tỏa nhiệt.
B. Phản ứng trên không có sự thay đổi năng lượng.
C. Phản ứng trên có sự hấp thu nhiệt từ môi trường xung quanh.
D. Khi tạo thành 1 mol H2O(g) thì nhiệt lượng tỏa ra là 571,68 kJ.
A. đúng
Câu 10. Cho phương trình nhiệt hóa học của phản ứng:
3Fe(s) + 4H2O(l) → Fe3O4(s) + 4H2(g)
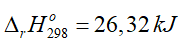
A. Phản ứng trên thu nhiệt.
B. Tổng enthalpy tạo thành của chất tham gia phản ứng lớn hơn của sản phẩm.
C. Ở điều kiện chuẩn, để tạo thành 1 mol Fe3O4(s) bằng phản ứng trên cần nhiệt lượng là 26,32 kJ.
D. Phản ứng này xảy ra thuận lợi ở điều kiện chuẩn.
A. đúng
C. đúng
Phần 2. Câu hỏi Trả lời ngắn
Câu 1. Cho phương trình nhiệt hóa học của phản ứng:
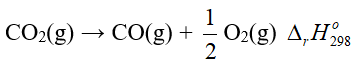
Giá trị 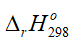 của phản ứng 2CO2(g) → 2CO(g) + O2(g) là bao nhiêu?
của phản ứng 2CO2(g) → 2CO(g) + O2(g) là bao nhiêu?
Đáp án: 560 kJ
Câu 2. Cho phương trình nhiệt hóa học của phản ứng:
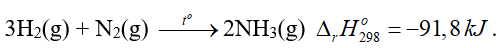
Lượng nhiệt tỏa ra khi dùng 9 g H2(g) để tạo thành NH3(g) là bao nhiêu kJ?
Đáp án: 137,7
nH2 = 4,5 (mol)
Cứ 3 mol H2 phản ứng tỏa ra 91,8 kJ nhiệt→ 4,5 mol H2 phản ứng tỏa ra lượng nhiệt là 4,5.91,8/3 = 137,7 kJ
Câu 3. Cho phương trình nhiệt hóa học của các phản ứng như sau:
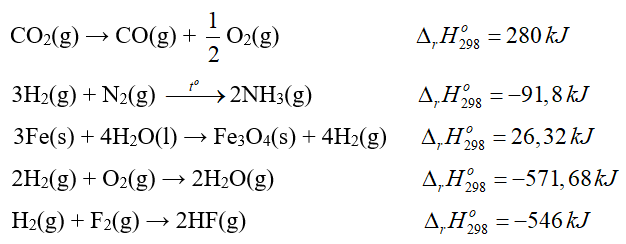
Có bao nhiêu phản ứng tỏa nhiệt?
Đáp án: 3
Câu 4. Cho phương trình nhiệt hóa học của phản ứng:
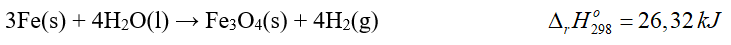
 của phản ứng Fe3O4(s) + 4H2(g) → 3Fe(s) + 4H2O(l) là bao nhiêu kJ?
của phản ứng Fe3O4(s) + 4H2(g) → 3Fe(s) + 4H2O(l) là bao nhiêu kJ?
Đáp án: 26,32
Câu 5. Điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và ở nhiệt độ không đổi, thường chọn nhiệt độ là aoC. Giá trị của a là bao nhiêu?
Đáp án: 25
Câu 6. Cho phương trình nhiệt hóa học của các phản ứng như sau:
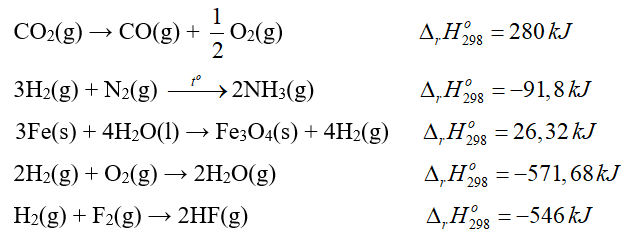
Có bao nhiêu phản ứng xảy ra không thuận lợi ở điều kiện chuẩn?
Đáp án: 2
Câu 7. Cho các chất sau: CaCO3(s), C(s), H2(g), O2(g), HCl(g), Na2O(s), CO2(g), Cl2(g), N2(g). Có bao nhiêu chất có 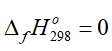 ?
?
Đáp án: 5
Câu 8. Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:

Để phản ứng xảy ra thì nhiệt lượng tối thiểu cần cung cấp là bao nhiêu J?
Đáp án: 180000J
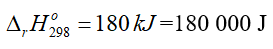
Câu 9. Cho phương trình nhiệt hóa học sau:
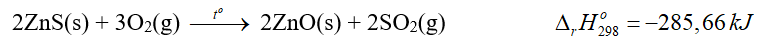
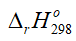 (kJ) của phản ứng là bao nhiêu nếu lấy gấp 3 lần khối lượng của các chất phản ứng?
(kJ) của phản ứng là bao nhiêu nếu lấy gấp 3 lần khối lượng của các chất phản ứng?
Đáp án: - 856.98
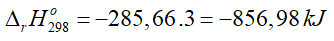
Câu 10. Điều chế NH3 từ N2(g) và H2(g) làm nguồn chất tải nhiệt, nguồn để điều chế nitric acid và sản xuất phân urea. Biết khi sử dụng 7 g khí N2 sinh ra 22,95 kJ nhiệt. Phương trình nhiệt hóa học của phản ứng được biểu diễn như sau:
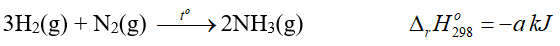
Giá trị của a là bao nhiêu?
Đáp án: 91,8
nH2 = 0,25 (mol)
Cứ 0,25 mol N2 phản ứng tỏa ra 22,95 kJ → 1 mol N2 phản ứng tỏa ra lượng nhiệt là 22,95/0,25 kJ
