(Cánh diều) Lý thuyết KHTN 8 Bài 7: Tốc độ phản ứng và chất xúc tác
Tóm tắt Lý thuyết Khoa học tự nhiên 8 Cánh Diều Bài 7. Tốc độ phản ứng và chất xúc tác theo chương trình Sách mới ngắn gọn nhất. Tổng hợp lý thuyết Khoa học tự nhiên 8 trọn bộ chi tiết, đầy đủ.
Bài 7. Tốc độ phản ứng và chất xúc tác
Soạn Khoa học tự nhiên 8 Cánh Diều Bài 7
I. Tốc độ phản ứng hóa học là gì?
- Tốc độ phản ứng là đại lượng chỉ mức độ nhanh hay chậm của một phản ứng hoá học.
- Phản ứng hoá học xảy ra với những tốc độ rất khác nhau, có phản ứng xảy ra rất nhanh như phản ứng đốt cháy và phản ứng xảy ra rất chậm như sự gỉ sắt.
II. Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
- Các yếu tố ảnh hưởng đến tốc độ phản ứng hoá học bao gồm diện tích bề mặt tiếp xúc, nhiệt độ, nồng độ, sự có mặt của chất xúc tác và chất ức chế. Diện tích bề mặt tiếp xúc càng lớn, tốc độ phản ứng càng nhanh. Vi dụ: nấu cháo từ bột gạo nhanh hơn nấu cháo từ hạt gạo.
- Diện tích bề mặt tiếp xúc: Diện tích bề mặt tiếp xúc càng lớn, tốc độ phản ứng càng nhanh.
- Nhiệt độ: Tăng nhiệt độ, phản ứng diễn ra với tốc độ nhanh hơn.
- Nồng độ ảnh hưởng đến tốc độ phản ứng hoá học. Nếu nồng độ càng cao, tốc độ phản ứng càng nhanh.
- Chất xúc tác và ức chế:
+ Chất xúc tác tăng tốc độ phản ứng, không bị thay đổi sau phản ứng.
+ Chất ức chế làm giảm tốc độ phản ứng. Các chất bảo quản là loại chất ức chế được sử dụng trong thực phẩm để ngăn ngừa sự thối rữa hay hư hỏng.
III. Trắc nghiệm Khoa học tự nhiên 8 Cánh Diều Bài 7 (có đáp án)
Câu 1: Trong phòng thí nghiệm, có thể điều chế khí oxi từ muối kali clorat. Người ta sử dụng cách nào sau đây nhằm mục đích tăng tốc độ phản ứng ?
A. Nung kaliclorat ở nhiệt độ cao.
B. Nung hỗn hợp kali clorat và mangan đioxit ở nhiệt độ cao.
C. Dùng phương pháp dời nước để thu khí oxi.
D. Dùng phương pháp dời không khí để thu khí oxi.
Giải thích:
- Trong phòng thí nghiệm, có thể điều chế khí oxi từ muối kali clorat. Người ta sử dụng nung hỗn hợp kali clorat và mangan đioxit ở nhiệt độ cao nhằm mục đích tăng tốc độ phản ứng.
- Ta có PTHH:
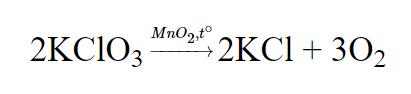
Câu 2: Trong quá trình sản xuất sulfuric acid có giai đoạn tổng hợp sulfur trioxide (SO3). Phản ứng xảy ra như sau: 2SO2 + O2 → 2SO3.
Khi có mặt vanadium(V) oxide thì phản ứng xảy ra nhanh hơn. Vanadium(V) oxide đóng vai trò gì trong phản ứng tổng hợp sulfur trioxide?
A. Chất phản ứng
B. Sản phẩm
C. Chất xúc tác
D. Không đóng vai trò gì
Câu 3: Than cháy trong bình khí oxygen nhanh hơn cháy trong không khí. Yếu tố nào ảnh hưởng đến tốc độ của phản ứng đốt cháy than?
A. Nồng độ
B. Không khí
C. Vật liệu
D. Hóa chất
Câu 4: Tốc độ phản ứng không phụ thuộc yếu tố nào sau đây.
A. Thời gian xảy ra phản ứng.
B. Bề mặt tiếp xúc giữa các chất phản ứng.
C. Nồng độ các chất tham gia phản ứng.
D. Chất xúc tác.
Giải thích:
Tốc độ phản ứng phụ thuộc vào 5 yếu tố:
- Yếu tố nồng độ
- Yếu tố chất xúc tác.
- Diện tích bề mặt tiếp xúc.
- Yếu tố áp suất
- Yếu tố nhiệt độ.
Câu 5: Các yếu tố ảnh hưởng đến cân bằng hoá học là .
A. nồng độ, nhiệt độ và chất xúc tác.
B. nồng độ, áp suất và diện tích bề mặt.
C. nồng độ, nhiệt độ và áp suất.
D. áp suất, nhiệt độ và chất xúc tác.
Giải thích:
- Nồng độ tăng → chất được tăng sẽ chuyển dịch theo chất tham gia phản ứng. Nồng độ giảm → chuyển dịch theo chiều sinh ra chất đó
- Nhiệt độ tăng → chuyển dịch theo chiều phản ứng thu nhiệt. Nồng độ giảm → chuyển dịch theo phản ứng tỏa nhiệt.
- Áp suất tăng → chuyển dịch theo chiều làm giảm số phân tử khí. Áp suất giảm → chuyển dịch theo chiều làm tăng số phân tử khí.
>>> Xem toàn bộ: Lý thuyết Khoa học tự nhiên 8 Cánh Diều
-------------------------------------------
Trên đây Toploigiai đã cùng các bạn Lý thuyết Khoa học tự nhiên 8 Cánh Diều Bài 7. Tốc độ phản ứng và chất xúc tác theo chương trình Sách mới ngắn gọn nhất. Mời các bạn hãy click ngay vào trang chủ Toploigiai để tham khảo và chuẩn bị bài cho năm học mới Lớp 8 nhé. Chúc các bạn học tốt.
