Trắc nghiệm Đúng sai Trả lời ngắn Hóa 11 Bài 5: Một số hợp chất quan trọng của nitrogen
Tổng hợp 20 câu Trắc nghiệm Đúng sai Trả lời ngắn Hóa 11 Bài 5: Một số hợp chất quan trọng của nitrogen có đáp án chi tiết bám sát chương trình học Sách mới năm học 2024-2025
Phần 1. Trắc nghiệm Đúng Sai
Câu 1. Từ công thức Lewis và dạng hình học (hình chóp tam giác) của phân tử NH3 được thể hiện hình dưới đây. Hãy cho biết, phân tử ammonia có những tính chất vật lí nào?
A. Ở điều kiện thường, ammonia ít tan trong nước.
B. Các liên kết N-H là liên kết cộng hóa trị phân cực.
C. Các phân tử ammonia dễ tạo liên kết hydrogen với nhau và với phân tử nước.
D. Ở điều kiện thường, ammonia là chất khí không màu, có mùi khai, xốc và độc.
B. đúng
C. đúng
D. đúng
Câu 2. Tính chất hóa học của ammonia là:
A. Tính base của ammonia là do trên nguyên tử nitrogen còn cặp electron hóa trị riêng.
B. Theo thuyết Brosted-Lowry, ammonia là một acid.
C. Khi tan trong nước, ammonia nhường H+ của nước tạo thành ion ammonium (NH4+).
D. Dung dịch ammonia có tính base yếu, làm quỳ tím hóa xanh.
A. đúng
D. đúng
Câu 3. Ammonia thể hiện tính khử là do:
A. Nguyên tử N trong phân tử NH3 có số oxi hóa -3, là số oxi hóa thấp nhất của nguyên tử nitrogen trong các hợp chất.
B. Ammonia thể hiện tính khử khi phản ứng với một số chất có tính oxi hóa.
C. Khi đun nóng hỗn hợp ammonia và oxygen trong bình kín ở nhiệt độ 800-900oC thì sinh ra khí NO2.
D. Dùng ammoinia tẩy rửa lớp copper(II) oxide ohur trên bề mặt kim loại đồng, tạo ra kim loại, nước và khí nitrogen.
A. đúng
B. đúng
D. đúng
Câu 4. Phân tử NH3 đóng vai trò là chất khử trong phản ứng:
A. 2NH3 + H2O2 +MnSO4 → MnO2 + (NH4)2SO4
B. 2NH3 + 3Cl2 → N2 + 6HCl
C. 4NH3 + 5O2 → 4NO + 6H2O
D. 2NH3 + 2 Na → 2NaNH2 + H2
A. đúng
B. đúng
C. đúng
Câu 5. Mỗi năm có hàng trăm triệu tấn ammonia được sản xuất trên toàn cầu. Ứng dụng của ammonia là:
A. Sản xuất phân đạm, cung cấp nguyên tố nitrogen cho cây trồng và sản xuất nitric acid (HNO3)
B. Sử dụng làm dung môi để hòa tan một số chất.
C. Sử dụng để làm lạnh nhanh, bảo quản thực phẩm.
D. Sản xuất một số chất gây nổ sử dụng trong khai thác quặng mỏ như NH4NO3.
A. đúng
B. đúng
D. đúng
Câu 6. Khi làm lạnh hỗn hợp khí gồm ammonia, hydrogen và nitrogen thì ammonia sẽ hoá lỏng trướC. Tính chất vật lí nào của các chất giúp giải thích hiện tượng trên?
A. Ammonia hóa lỏng ở nhiệt độ (-33,3°C) cao hơn hydrogen (-252,87°C) và nitrogen (-196°C)
B. Liên kết N-H là liên kết công hóa trị phân cực
C. liên kết giữa phân tử H2 và N2 là liên kết không phân cực bền vững hơn.
D. Ammonia tan nhiều trong nước vì tạo được liên kết hydrogen với nước.
A. đúng
B. đúng
C. đúng
Câu 7. Muối ammonium là các hợp chất có chứa ion ammonium (NH4+) và gốc acid. Vậy muối ammonium có những tính chất nào dưới đây?
A. Muối amoni bền với nhiệt.
B. Các muối amoni đều là chất điện li mạnh.
C. Hầu hết các muối amoni đều tan tốt trong nước.
D. Các muối amoni không bị thủy phân trong nước.
B. đúng
C. đúng
Câu 8. HNO3 tác dụng được với tất cả các chất nào trong các dãy sau:
A. BaO, CO2.
B. Al, Na2CO3.
C. Na2O, Na2SO4.
D. Cu, MgO.
B. đúng
D. đúng
Câu 9. Nitric acid (HNO3) là chất lỏng không màu, có tính acid mạnh, tính oxi hóa mạnh và có nhiều ứng dụng trong đời sống như:
A. Điều chế phân đạm NH4NO3, Ca(NO3)2.
B. Sản xuất dược phẩm, thuốc nổ, thuốc nhuộm.
C. Làm gia vị cho thực phẩm.
D. Sản xuất khí NO2 và N2H4.
A. đúng
B. đúng
Câu 10. Biến thiên enthalpy chuẩn của phản ứng tổng hợp ammonia từ nitrogen và hydrogen có giá trị âm nhưng vì sao quá trình Haber lại chọn nhiệt độ phản ứng khá cao, vào khoảng 400 °C – 600 °C?
A. Phản ứng thuận tỏa nhiệt (H < 0).
B. Phản ứng thuận thu nhiệt (H > 0).
C. Giảm nhiệt độ để phản ứng xảy ra theo chiều thuận.
D. Tăng nhiệt độ để phản ứng xảy ra theo chiều thuận.
A. đúng
C. đúng
Phần 2. Câu hỏi Trả lời ngắn
Câu 1. Xác định số oxi hóa của nitrogen trong các chất sau: NH3, N2. N2O. NO, NO2, HNO3.
Đáp án: -3, 0, +1, +2, +4, +5
Câu 2. Xác định hệ số cân bằng của HNO3 trong phản ứng:
Cu+ HNO3 → Cu(NO3)2 + NO + H2O
Đáp án: 8
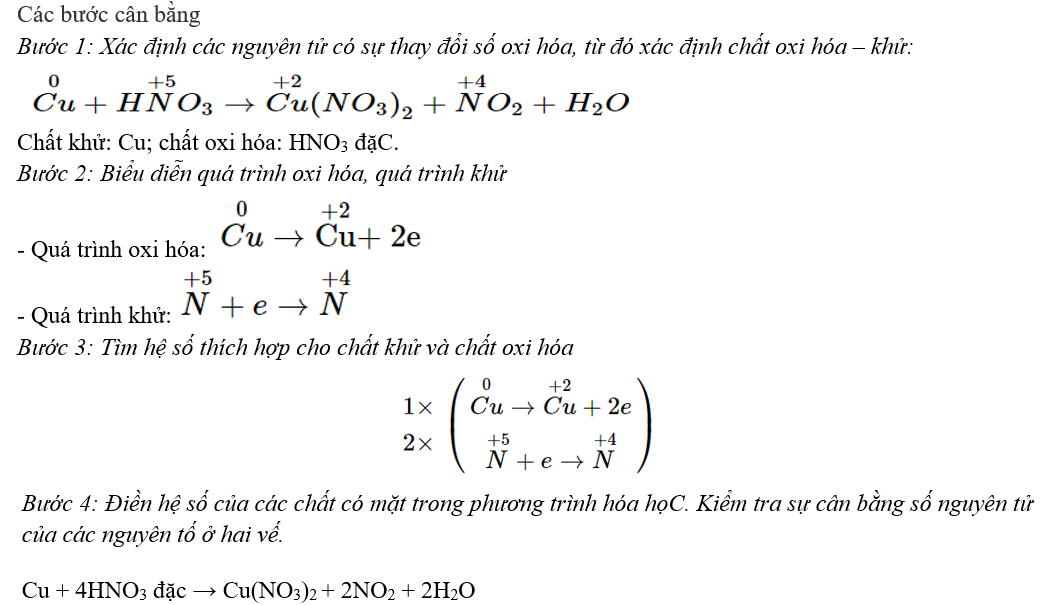
Câu 3. Cho 100ml dung dịch NaOH 2M phản ứng hết với dung dịch NH4Cl dư thu được V(l) khí đktc. Tính V.
Đáp án: 4,48
nNaOH= CM.V= 2.0,1= 0,2 mol.
PTHH: NaOH + NH4Cl → NaCl + NH3 + H2O
0,2 → 0,2
VNH3= n.22,4= 0,2.22,4= 4,48 (l).
Câu 4. Dẫn 1,344 lít NH3 vào bình chứa 0,672 lít khí Cl2. Tính khối lượng muối NH4Cl tạo thành.
Đáp án: 2,14
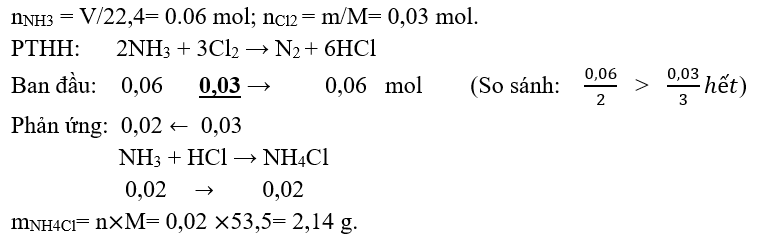
Câu 5. Phú dưỡng là hệ quả sau khi ao ngòi, song hồ nhận quá nhiều các nguồn thải chứa các chất dinh dưỡng chứa nguyên tố nitrogen, phosphorus. Khi hàm lượng nitrogen và phosphorus vượt quá ngưỡng nào thì xảy ra hiện tượng phú dưỡng?
Đáp án: Nitrogen ≥ 300 µg/l, Phosphorus ≥ 320 µg/l
Thông thường, khi hàm lượng Nitrogen ≥ 300 µg/l và Phosphorus ≥ 320 µg/l trong nước thì xảy ra hiện tượng phú dưỡng.
Câu 6. Hòa tan hoàn toàn m gam Fe vào dung dịch HNO3 loãng thì thu được 0,448 lít khí NO duy nhất (đktc). Xác định giá trị của m.
Đáp án: 1,12g
nNO= V/22,4= 0,02 mol
Quá trình nhường e
Fe0 →Fe+3 + 3e
0,02 0,06
Quá trình nhận e
N+5+3e →N +2
0,06 0,02
=> mFe = 0,02.56 = 1,12 gam.
Câu 7. Hòa tan 4,59 gam Al bằng dung dịch HNO3 thu được hỗn hợp khí NO và N2O có tỉ khối hơi đối với hidrogen bằng 16,75 và dung dịch chỉ chứa muối kim loại. Tính thể tích NO và N2O thu được ở đktc.
Đáp án: 2,016 lít và 0,672 lít.

Câu 8. Quá trình đốt cháy nhiên liệu trong ô tô sinh ra nhiều khi như SO2, CO, NO. Từ năm 1975, người ta thiết kế “bộ chuyển đổi xúc tác” trong hệ thống xả khí của ô tô (và cả trong máy phát điện) nhằm tạo điều kiện thuận lợi cho phản ứng:
2CO(g) + 2NO(g) → 2CO2(g) + N2(g)
Giá trị enthalpy tạo thành chuẩn của CO(g), NO(g), CO2(g) lần lượt là 110,5; 91,3; –393,5 (kJ mol−1). Hãy tính biến thiên enthalpy chuẩn của phản ứng trên. Phản ứng này có thuận lợi về mặt năng lượng không? Giải thích.
Đáp án: -248,2 kJ mol−1

Câu 9. Cho 4 lít N2 và 14 lít H2 vào bình phản ứng, hỗn hợp thu được sau phản ứng có thể tích bằng 16,4 lít (các thể tích khí được đo trong cùng điều kiện). Hiệu suất phản ứng là bao nhiêu?
Đáp án: 0,8
N2+ 3H2 ⇌ 2NH3
Ở cùng điều kiện thì tỉ lệ về thể tích chính là tỉ lệ về số mol
Do 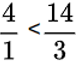 →Hiệu suất tính theo N2
→Hiệu suất tính theo N2
Đặt thể tích N2 phản ứng là x lít
→VH2 pứ= 3x lít, VNH3 sinh ra = 2x (lít)
VN2 dư= 4-x (lít), VH2 dư= 14-3x (lít)
Sau phản ứng thu được N2 dư, H2 dư, NH3
Tổng thể tích khí thu được là
Vkhí= VH2 dư+ VN2 dư+ VNH3= 14-3x + 4-x+ 2x = 16,4
→ x = 0,8 lít
Câu 10. Ở 472 °C, hằng số cân bằng của phản ứng tổng hợp ammonia từ nitrogen và hydrogen theo quá trình Haber là Kc = 0,105. Giả sử, kết quả phân tích cho thấy tại thời điểm cân bằng, nồng độ của nitrogen và hydrogen trong buồng phản ứng lần lượt là 0,1806 M và 0,0603 M. Hãy tính nồng độ mol của ammonia có trong buồng phản ứng tại thời điểm cân bằng.
Đáp án: 6,79×10-4(M)
PTHH: N2(g) + 3H2(g) ⇌ 2NH3(g)
Ban đầu: a b 0 (M)
Phản ứng: x 3x 2x (M)
Cân bằng: 0,0603 0,1806 2x (M)
Ta có: KC=[NH3]2/[N2]×[H2]3⟺ 2x3/0,0603×(0,1806)3=0,105⟹x=6,79×10-4 (M)
Vậy nồng độ mol của ammonia có trong buồng phản ứng tại thời điểm cân bằng là 6,79.10−4 M
