Trắc nghiệm Đúng sai Trả lời ngắn Hóa 11 Bài 3: pH của dung dịch - Chuẩn độ acid - base
Tổng hợp 20 câu Trắc nghiệm Đúng sai Trả lời ngắn Hóa 11 Bài 3: pH của dung dịch - Chuẩn độ acid - base có đáp án chi tiết bám sát chương trình học Sách mới năm học 2024-2025
Phần 1. Trắc nghiệm Đúng Sai
Câu 1. Các acid như acetic acid trong giấm ăn, citric acid trong quả chanh, oxalic acid trong quả khế đều tan và phân li trong nước. Chẳng hạn, acetic acid (CH3COOH) phân li theo phương trình sau:
CH3COOH ⇌ CH3COO- + H+
A. Vị chua của các acid trên được gây ra bởi ion H+.
B. Trong chế biến nước chấm, càng cho nhiều giấm ăn thì nước chấm càng chua.
C. Để xác định được nồng độ ion H+ trong dung dịch acid cần xác định được pH của chất.
D. Acetic acid là chất khi tan tron nước phân ly hoàn toàn thành các ion.
A. đúng
B. đúng
C. đúng
Câu 2. Nước điện li tạo ra đồng thời cả H+ và OH-:
H2O ⇌ H+ + OH-
A. Ở 25 °C, [H+] = [OH-] = 10-7 M, nước được coi là chất điện ly mạnh.
B. Khi cho một acid vào nước, dung dịch acid có [H+] > [OH-].
C. Khi cho một base vào nước,dung dịch base có [H+] > 10-7 M.
D. Nước nguyên chất có môi trường trung tính.
B. đúng
D. đúng
Câu 3. Hai dung dịch HCl và CH3COOH có cùng nồng độ 0,1 M. Nhưng
A. Nồng độ H+ trong hai dung dịch đều là 0,1 M.
B. Dung dịch HCl có tính acid mạnh hơn dung dịch CH3COOH.
C. Dung dịch HCl có giá trị pH cao hơn dung dịch CH3COOH.
D. HCl thuộc loại acid mạnh, CH3COOH thuộc loại acid yếu.
B. đúng
D. đúng
Câu 4. Dịch vị dạ dày của con người có chứa acid HCl với pH dao động khoảng 2 - 4. Đây là khoảng pH phù hợp đê các enzyme tiêu hoá (các chất xúc tác sinh học) hoạt động hiệu quả.
A. Nồng độ H+ trong dịch vị dạ dày của con người từ khoảng 10-4 đến 10-2 M.
B. Việc thiếu acid trong dạ dày là một nguyên nhân gây nên bệnh nhiễm khuẩn đường tiêu hoá.
C. Khi điều trị bệnh thừa acid trong dạ dày người ta thường sử dụng thuốc muối NaHCO3.
D. Nếu trong dịch vị dạ dày của người nào đó có pH < 1 thì người này đang mắc bệnh lý về dạ dày.
A. đúng
B. đúng
C. đúng
D. đúng
Câu 5. Thí nghiệm chuẩn độ dung dịch NaOH chưa biết chính xác nồng độ (biết nồng độ trong khoảng gần với 0,1 M) bằng dung dịch chuẩn HCl 0,1 M với chất chỉ thị phenolphthalein.
A. Có thể thay dung dịch chuẩn bằng dung dịch CH3COOH.
B. Thí nghiệm chuẩn độ chỉ cần thực hiện 1 lần duy nhất là có kết quả chính xáC.
C. Tại điểm tương đương, HCl hết nên nếu thêm tiếp NaOH, dung dịch sẽ chuyển sang màu hồng.
D. Giả sử khi kết thúc chuẩn độ, thể tích trung bình của dung dịch NaOH đã sử dụng ở burette là 10,27 mL, thì nồng độ của dung dịch NaOH là 0,1027M.
C. đúng
Câu 6. Tại khu vực bị ô nhiễm, pH của nước mưa đo được là 4,5 còn pH của nước mưa tại khu vực không bị ô nhiễm là 5,7.
A. Nồng độ ion H+ trong dung dịch nước mưa bị ô nhiễm là 10-4,5.
B. Nồng độ ion H+ trong dung dịch nước mưa không bị ô nhiễm là 10-5,7.
C. Nồng độ ion H+ trong nước mưa bị ô nhiễm thấp hơn so với trong nước mưa không bị ô nhiễm.
D. Nồng độ ion OH- trong nước mưa bị ô nhiễm thấp hơn so với trong nước mưa không bị ô nhiễm.
A. đúng
B. đúng
D. đúng
Câu 7. Giá trị pH của một dung dịch tăng từ 3 đến 5. Có các nhận định
A. Nồng độ OH- của dung dịch khi pH = 5 là 10-9 M.
B. Nồng độ H+ của dung dịch khi pH = 3 là 10-3 M.
C. Dung dịch ban đầu là một acid có nồng độ H+ là 0,001 M.
D. Dung dịch ban đầu là một base có nồng độ 0,001 M.
A. đúng
B. đúng
C. đúng
Câu 8. Cho ba dung dịch có cùng nồng độ: hydrochloric acid (HCl), ethanoic acid (acetic acid, CH3COOH) và sodium hydroxide (NaOH). Khi chuẩn độ riêng một thể tích như nhau của dung dịch HCl và dung dịch CH3COOH bằng dung dịch NaOH.
A. Trước khi chuẩn độ, pH của hai acid bằng nhau.
B. Tại các điểm tương đương, dung dịch của cả hai phép chuẩn độ đều có giá trị bằng 7.
C. Cần cùng một thể tích sodium hydroxide để đạt đến điểm tương đương.
D. Giá trị pH của hai acid tăng như nhau cho đến khi đạt điểm tương đương.
C. đúng
Câu 9. Cho các dung dịch: HCl, H2SO4, có cùng nồng độ 0,01M.
A. Nồng độ H+ trong dung dịch HCl 0,01 M.
B. Nồng độ H+ trong dung dịch HCl lớn hơn nồng độ H+ trong dung dịch H2SO4
C. Dung dịch H2SO4 có pH lớn nhất.
D. Nhúng quỳ tím vào 2 dung dịch trên thì quỳ tím chuyển sang màu đỏ.
A. đúng
D. đúng
Câu 10. Có 4 dung dịch: sodium chloride (NaCl), alcohol ethylic (C2H5OH), acetic acid (CH3COOH), potassium sulfate (K2SO4) đều có nồng độ 0,1M.
A. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự là
B. Dung dịch acetic acid (CH3COOH) là chất điện li yếu.
C. Sodium chloride (NaCl), potassium sulfate (K2SO4) là chất điện li mạnh.
D. Alcohol ethylic (C2H5OH) là chất điện li yếu.
A. đúng
B. đúng
C. đúng
Phần 2. Câu hỏi Trả lời ngắn
Câu 1. Cho các dung dịch sau: Na2CO3, AlCl3, CH3COOK, Ba(NO3)2. Dựa vào thuyết Bronsted – Lowry, em hãy xác định số dung dịch có pH > 7?
Đáp án: 2
Dung dịch Na2CO3 và CH3COOK có pH > 7
Câu 2. Ở 25oC, pH của dung dịch Ca(OH)2 là 12,3. Để thu được 400 mL dung dịch Ca(OH)2 trên thì khối lượng Ca(OH)2 (g) cần phải hòa tan là bao nhiêu?
Đáp án: 0,296
Ta có: [OH-]=10-14 : 10-12,3 = 10-1,7M = 0,02M → Nồng độ của Ca(OH)2 tương ứng là 0,01M.
Khối lượng Ca(OH)2 = 0,01.0,4.74=0,296 gam
Câu 3. Một loại dầu gội có nồng độ ion OH- là 10-5,17M. Tính pH của loại dầu gội nói trên.
Đáp án: 8,83
Ta có: [H+]=10-14 : 10-5,17 = 1,48.10-9 M → pH=8,83
Câu 4. Một mẫu dịch vị có pH=2,5. Xác định nồng độ mol của ion H+ trong mẫu dịch vị đó.
Đáp án: 10-2,5 M
Câu 5. Pha 500 mL dung dịch HCl 0,2M vào 500 mL nước. Tính pH của dung dịch thu được.
Đáp án: 1
nHCl = 0,1 mol ; Vdd=1 Lít
pH=1
Câu 6. Tính pH của dung dịch có khi nồng độ OH- là 10-4M
Đáp án: 10
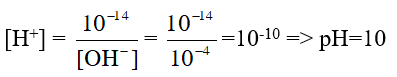
Câu 7. Để trung hoà 10 mà dung dịch HCl nồng độ x M cần 50 ml dung dịch NaOH 0,5 M. Xác định giá trị của x.
Đáp án: 2,5
nNaOH = 0,05.0,5 = 0,025 mol
HCl + NaOH → NaCl + H2O
0,025 0,025 ( mol)
Vậy 0,01. x = 0,025 => x = 2,5 M
Câu 8. Cho các chất dưới đây: HClO4, HClO, HF, HNO3, H2S, H2SO3, NaOH, NaCl, CuSO4, CH3COOH. Có bao nhiêu chất thuộc loại chất điện li mạnh ?
Đáp án: 5
HClO4,HNO3, NaOH, NaCl, CuSO4
Câu 9. Tính khối lượng NaOH cần dùng để pha được 100ml dung dịch NaOH có pH=12.
Đáp án: 0,04
Từ pH =12 => [H+] = 10-12M =>[OH-] = 10-14/ 10-12 = 10-2M= nOH-(NaOH)/0,1
=>nNaOH = 0,001 mol
mNaOH = 0,001.40 = 0,04 gam
Câu 10. Một mẫu dịch vị có pH=9. Xác định nồng độ mol của ion OH- trong mẫu dịch vị đó.
Đáp án: 10-5 M
Ta có: [H+]=10-9 M nên [OH-]=10-5 M
