Trắc nghiệm Đúng sai Trả lời ngắn Hóa 10 Bài 7: Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Tổng hợp 20 câu Trắc nghiệm Đúng sai Trả lời ngắn Hóa 10 Bài 7: Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học có đáp án chi tiết bám sát chương trình học Sách mới năm học 2024-2025
Phần 1. Trắc nghiệm Đúng Sai
Câu 1. Trong bảng tuần hoàn các nguyên tố hóa học
A. Trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử thì tính kim loại giảm dần, tính phi kim tăng dần.
B. Trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử bán kính nguyên tử và độ âm điện đều giảm.
C. Trong một nhóm A (trừ nhóm VIIIA), theo chiều tăng của điện tích hạt nhân nguyên tử, tính kim loại tăng dần, độ âm điện tăng dần.
D. Theo chiều tăng của điện tích hạt nhân nguyên tử Khối lượng nguyên tử không biến đổi tuần hoàn .
A. đúng
D. đúng
Câu 2. Nguyên tố X có hình electron là [Ne]3s23p1
A. X là một nguyên tố kim loại được dùng làm vỏ lon nước giải khát.
B. Nguyên tố X là một oxide basic.
C. Nguyên tố X nằm ô số 13, chu kì 3, nhóm IIIA.
D. Nguyên tố X có số electron ở phân lớp ngoài cùng là 3.
A. đúng
C. đúng
Câu 3. Nguyên tố Ca có số hiệu nguyên tử là 20.
A. Số electron ở hạt nhân của nguyên tố Ca là 20.
B. Vỏ của nguyên tử Ca có 4 lớp electron và lớp ngoài cùng có 2 electron.
C. Số proton ở hạt nhân của nguyên tố Ca là 20.
D. Nguyên tố Ca là một kim loại.
B. đúng
C. đúng
D. đúng
Câu 4. Nguyên tố R thuộc nhóm VA của bảng tuần hoàn các nguyên tố hóa học.
A. Nguyên tố R là phi kim mạnh trong cùng chu kì.
B. Nguyên tố R có 5 electron hóa trị.
C. Hóa trị cao nhất với oxygen là V.
D. Công thức hợp chất khí với H của R là R2H5.
B. đúng
C. đúng
Câu 5. Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng dần
A. điện tích hạt nhân nguyên tử.
B. khối lượng nguyên tử.
C. độ âm điện nguyên tử.
D. số hiệu nguyên tử.
A. đúng
D. đúng
Câu 6. Các ion M+ và Y2- có cấu hình electron phân lớp ngoài cùng là 3p6 .
A. M phản ứng mãnh liệt với nước ở điều kiện thường.
B. Y là chất rắn ở điều kiện thường.
C. M thuộc chu kì 3, nhóm VIA, Y thuộc chu kì 4 nhóm IA.
D. M là nguyên tố p, Y là nguyên tố s.
A. đúng
B. đúng
Câu 7. Hình bên dưới mô tả ô nguyên tố của Chlorine trong bảng tuần hoàn các nguyên tố hóa học:

A. Chlorine có kí hiệu là Cl; nguyên tử khối trung bình là 35,45; nguyên tử có 17 neutron.
B. Chlorine thuộc ô số 17, chu kì 3, nhóm VIIA.
C. Chlorine có thể tạo thành ion Cl-, có cấu hình electron giống với khí hiếm Ar.
D. Chlorine là nguyên tố có độ âm điện lớn nhất trong bảng tuần hoàn.
B. đúng
C. đúng
Câu 8. Nguyên tử nguyên tố X có tổng electron ở phân lớp d bằng 6.
A. Nguyên tố X có tính kim loại trung bình.
B. Nguyên tố X thuộc nguyên tố D.
C. Nguyên tố X nằm ô 26, chu kì 4, nhóm VIB.
D. Nguyên tố X có cấu hình electron là 1s22s22p63s23p64s23d6.
A. đúng
B. đúng
Câu 9. Sodium (11Na), sulfur (16S) thuộc cùng chu kì trong bảng tuần hoàn
A. Trong bảng tuần hoàn, Na có tính kim loại mạnh nhất, S có tính phi kim mạnh nhất.
B. Khi phản ứng với oxygen, Na và S đều tạo hợp chất ion.
C. Nguyên tố Na có độ âm điện nhỏ hơn nguyên tố S.
D. Nguyên tố Na thuộc nhóm IA, nguyên tố S thuộc nhóm VIA.
C. đúng
D. đúng
Câu 10. Cho các nguyên tố X, Y, Z với số hiệu nguyên tử lần lượt là 4, 12, 20
A. Các nguyên tố này đều là kim loại mạnh nhất trong chu kì.
B. Các nguyên tố này đều có cấu hình electron lớp ngoài cùng giống nhau.
C. Thứ tự tăng dần tính base là X(OH)2 < Y(OH)2 < Z(OH)2.
D. Thứ tự tăng dần độ âm điện: X < Y < Z.
B. đúng
C. đúng
Phần 2. Câu hỏi Trả lời ngắn
Câu 1. Số hiệu nguyên tử của các nguyên tố X, A, M, Q lần lượt là 6, 7, 20, 19. Trong số các nguyên tố trên có bao nhiêu nguyên tố là kim loại?
Đáp án: 2
X (Z=6) 1s22s22p2
A (Z=7) 1s22s22p3
Q (Z=19) 1s22s22p63s23p64s1
M (Z=20) 1s22s22p63s23p64s2
Chỉ có Q có 1 electron lớp ngoài cùng, M có 2 eletron lớp ngoài cùng.
=> M, Q là kim loại.
Câu 2. Hợp chất khí với hydrogen của nguyên tố X có công thức XH4, được sử dụng làm tác nhân ghép nối để bám dính các sợi như sợi thủy tinh và sợi carbon. Oxide cao nhất của X chứa 53,3% oxygen về khối lượng, thường được dùng để sản xuất cửa sổ, lọ thủy tinh. Hãy cho biết giá trị nguyên tử khối trung bình của X là bao nhiêu?
Đáp án: 28
Ta có: hợp chất khí với hydrogen của nguyên tố X có công thức XH4
=> công thức oxide cao nhất của X là XO2
Ta có: Oxide cao nhất của X chứa 53,3% oxygen về khối lượng
=> 53,3 = (32/ 32 + 2X) .100
=> X = 28
Câu 3. Một nguyên tố tạo hợp chất khí với hydrogen có công thức là RH3, được dùng để trung hòa các thành phần acid của dầu thô, bảo vệ thiết bị không bị ăn mòn trong ngành công nghiệp dầu khí. Nguyên tố này chiếm 25,93% về khối lượng trong oxide cao nhất. Hãy cho biết giá trị nguyên tử khối trung bình của R là bao nhiêu?
Đáp án: 14
Ta có: hợp chất khí với hydrogen có công thức là RH3
=> công thức oxide cao nhất của R là R2O5.
Ta có: nguyên tố này chiếm 25,93% về khối lượng trong oxide cao nhất.
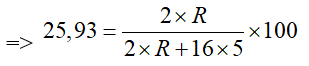
=> R = 14
=> R là Si thuộc chu kì 3, nhóm IVA.
Câu 4. Cho các nguyên tố: X (Z=2); Y (Z=9); T (Z=12); M (Z=13); A (Z=14). Có bao nhiêu nguyên tố thuộc cùng một chu kì?
Đáp án: 3
X (Z=2) 1s2
Y (Z=9) 1s22s22p5
T (Z=12) 1s22s22p63s2
M (Z=13) 1s22s22p63s23p1
A Z=(14) 1s22s22p63s23p2
Chu kì là các nguyên tố có cùng số lớp electron.
=> T, M, A có cùng số lớp electron.
Câu 5. Phosphorus được dùng vào mục đích quân sự như sản xuất bom, đạn cháy, đạn khói. Nguyên tố phosphorus ở ô số 15, chu kì 3, nhóm VA trong bảng hệ thống tuần hoàn. Hãy cho biết số electron lớp ngoài cùng của phosphorus là bao nhiêu?
Đáp án: 5
Nguyên tố phosphorus ở ô số 15, chu kì 3, nhóm VA trong bảng hệ thống tuần hoàn
Số electron lớp ngoài cùng= số nhóm A => P có 5 electron lớp ngoài cùng.
Câu 6. Cho 6 gam calcium tác dụng hết với nước phản ứng xảy ra hoàn toàn thu được V lít H2 (đo ở điều kiện chuẩn). Hãy cho biết giá trị của V là bao nhiêu?
Đáp án: 3,72
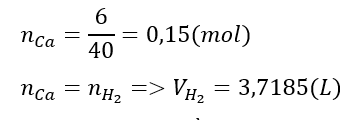
Câu 7. Nguyên tố potassium thuộc ô 19 trong bảng tuần hoàn. Hóa trị của postassium trong công thức oxide cao nhất là bao nhiêu?
Đáp án: 1
Nguyên tố potassium thuộc ô 19 trong bảng tuần hoàn. Nên K nằm ô 19, chu kì 4, nhóm IA.
Câu 8. Cho cấu hình electron của các nguyên tố sau: [Ne]3s23p3, [Ar]3d14s2, [Ar]3d74s2, [Ar]3d54s2.
Trong số các nguyên tố trên có bao nhiêu nguyên tố thuộc nhóm A?
Đáp án: 1
Dựa cấu hình electron ta thấy [Ne]3s23p3 thuộc A
Câu 9. Nguyên tử A ở chu kì 3, nhóm VIA. Hãy cho biết số electron có trong nguyên tử của nguyên tố A là bao nhiêu?
Đáp án: 16
Nguyên tử A ở chu kì 3, nhóm VIA.
=> Cấu hình electron của A: 1s22s22p63s23p4
=> Nguyên tử A có 16 electron.
Câu 10. Oxide cao nhất của nguyên tố R thuộc nhóm VIA có 60% oxygen về khối lượng, là một sản phẩm trung gian để sản xuất acid H2SO4 có tầm quan trọng bậc nhất trong công nghiệp. Phần trăm về khối lượng của R trong hợp chất khí với hydrogen là bao nhiêu?
Đáp án: 94,12%
Oxide cao nhất của nguyên tố R thuộc nhóm VIA có 60% oxygen về khối lượng.
=> Oxide cao nhất của nguyên tố R là RO3.
=> 60 = ((16x3)/(16x3+R))x100 => R = 32(S)
Phần trăm của R trong hợp chất khí với hydrogen là
%S = 32/34 x100 =94,12%
