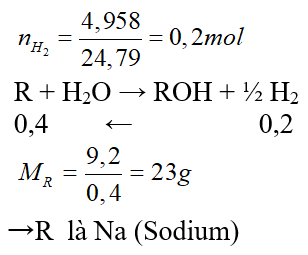Trắc nghiệm Đúng sai Trả lời ngắn Hóa 10 Bài 5: Cấu tạo tuần hoàn các nguyên tố hóa học
Tổng hợp 20 câu Trắc nghiệm Đúng sai Trả lời ngắn Hóa 10 Bài 5: Cấu tạo tuần hoàn các nguyên tố hóa học có đáp án chi tiết bám sát chương trình học Sách mới năm học 2024-2025
Phần 1. Trắc nghiệm Đúng Sai
Câu 1. Cấu tạo bảng Hệ thống tuần hoàn (HTTT) có
A. 3 chu kỳ nhỏ, 4 chu kỳ lớn
B. 8 nhóm A, 8 nhóm B
C. Mỗi chu kỳ nhỏ có 8 nguyên tố
D. Mỗi chu kỳ lớn có 32 nguyên tố
A. đúng
B. đúng
Câu 2. Cách sắp xếp các nguyên tố trong bảng HTTH theo quy tắc
A. Tăng dần điện tích hạt nhân.
B. Tăng dần nguyên tử khối
C. Tăng dần theo số hiệu nguyên tử
D. Tăng dần theo độ âm điện
A. đúng
C. đúng
Câu 3. Nguyên tắc sắp xếp các nguyên tố vào bảng tuần hoàn
A. Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử
B. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp vào cùng một cột
C. Các nguyên tố có cùng số electron hóa trị được xếp vào một hàng
D. Số thứ tự của ô nguyên tố bằng số hiệu của nguyên tố đó
A. đúng
D. đúng
Câu 4. Nguyên tử của nguyên tố A có tổng số electron ở phân lớp p là 5, vị trí của nguyên tố A trong bảng tuần hoàn là
A. ô 16.
B. nhóm VIIA.
C. chu kì 3.
D. Nguyên tố A là Sulfur.
B. đúng
C. đúng
Câu 5. Các nguyên tố X, Y, Z, K có số hiệu nguyên tử tương ứng là 4, 8, 16, 25.
A. Nguyên tố X thuộc chu kì 2, nhóm IV
B. Nguyên tố K thuộc chu kì 2, nhóm VI
C. Nguyên tố Y thuộc chu kì 3, nhóm VI
D. Nguyên tố Z thuộc chu kì 3, nhóm VI
B. đúng
C. đúng
Câu 6. Nguyên tử X có phân lớp electron ngoài cùng là 3p4. Đặc điểm khi nói về nguyên tử X
A. Lớp ngoài cùng của X có 6 electron
B. Hạt nhân nguyên tử X có 16 electron
C. Trong bảng tuần hoàn X nằm ở chu kì 3
D. X nằm ở nhóm VIIA
A. đúng
C. đúng
Câu 7. Số thứ tự của ô nguyên tố
A. Là số hiệu nguyên tử của nguyên tố trong ô
B. Bằng số neutron của nguyên tố
C. Kí hiệu là n
D. Bằng số điện tích hạt nhân của nguyên tố
A. đúng
D. đúng
Câu 8. Nguyên tố X có cấu hình electron là 1s22s22p3 , đặc điểm của nguyên tố X
A. Chu kì 2, nhóm VA, HXO3
B. Chu kì 2, nhóm VA, XH4
C. Chu kì 2, nhóm VA, XH3
D. Chu kì 2, nhóm VA, XH2
A. đúng
C. đúng
Câu 9. Cho các nguyên tố: He (4), Mg (12); Al (13); Si (14); P (15); Ca (20). Các nguyên tố trên có một số đặc điểm
A. Mg, Ca, Al là kim loại
B. P, Si, He là phi kim
C. Mg, Si, Ca thuộc nhóm IIA
D. Al, Si, P thuộc chu kỳ 3
A. đúng
D. đúng
Câu 10. Nguyên tử của một nguyên tố có cấu hình electron như sau:
(1)1s22s22p1 (2)1s22s22p4 (3)1s22s22p63s23p1 (4)1s22s22p63s23p5
A. (1) và (2) cùng chu kỳ, (3) và (4) cùng chu kỳ
B. (1) và (3) cùng nhóm, (2) và (4) cùng nhóm
C. (2) và (4) là phi kim, (1) và (3) là kim loại
D. (2) và (3) là phi kim, (1) và (4) là kim loại
A. đúng
C. đúng
Phần 2. Câu hỏi Trả lời ngắn
Câu 1. A và B là 2 nguyên tố thuộc cùng nhóm A và thuộc 2 chu kì liên tiếp trong BTH. Tổng số hạt proton trong 2 hạt nhân nguyên tử A, B bằng 30. Xác định A, B.
Đáp án: K, Na
Gọi ZA, ZB lần lượt là số hạt proton của nguyên tử A và nguyên tử B
Theo bài ra ta có
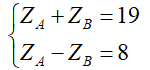
Giải (1) và (2) ta được ZA = 19; ZB = 11.
A là K
B là Na
Câu 2. Hai nguyên tố C, D đứng kế tiếp nhau trong 1 chu kì, tổng số khối của chúng là 51. Số nơtron của D lớn hơn của C là 2, số electron của C bằng số nơtron của nó. Xác định các nguyên tố trên và viết cấu hình electron của chúng.
Đáp án: Mg (Z=12) 1s22s22p63s2; Al (Z=13) 1s22s22p63s23p1
Gọi ZC, ZD, NC, ND lần lượt là số hạt proton, số hạt nơtron của nguyên tử C và nguyên tử D
Theo bài ra ta có ZC + ZD + NC + ND = 51 (1)
ND – NC = 2 => ND = NC +2 (2)
ZC = NC (3)
Thay (2), (3) vào (1)ta được 3ZC + ZD = 49
=> số proton trung bình của ZC, ZD là 49/4 = 12,75 mà C, D đứng kế tiếp nhau trong 1 chu kì nên
Nếu ZC = 12 => ZD = 13 => C là Mg, D là Al
Cấu hình electron Mg (Z=12) 1s22s22p63s2; Al (Z=13) 1s22s22p63s23p1
Câu 3. Nguyên tử của nguyên tố A có tổng số hạt cơ bản là 60, trong hạt nhân số hạt mang điện bằng số hạt không mang điện. Xác định vị trí của A trong bảng HTTH.
Đáp án: Ca: ô 20, chu kì 4, nhóm IIA
2ZA + NA = 60
=>ZA = NA = 20
=> Cấu hình electron của A là 1s22s22p63s23p64s2
A là nguyên tố Ca: ô 20, chu kì 4, nhóm IIA trong BTH
Câu 4. A và B là 2 nguyên tố thuộc 2 nhóm A liên tiếp trong BTH. Tổng số hạt proton trong nguyên tử A, B bằng 19. A, B tạo được hợp chất X có tổng số proton là 70. Xác định cấu hình e của nguyên tử A, B.
Đáp án: Al (Z=13) 1s22s22p63s23p1, C (Z = 6) 1s22s22p2
Gọi ZA, ZB lần lượt là số hạt proton của nguyên tử A và nguyên tử B
Gọi CTPT của hợp chất X là AxBy
Theo bài ra ta có ZA + ZB = 19 (1)
xZA + yZB = 70 (2)
Từ (1) và (2) ta có nhóm trung bình của A và B là 70/19 = 3,6
Mà A, B thuộc 2 nhóm A liên tiếp => A thuộc nhóm IIIA, B thuộc nhóm IVB
=> x = 4, y = 3 thay vào phương trình (2) ta có 4x + 3y = 70 (3)
Giải phương trình (1) và (3) ta được ZA = 13; ZB = 6
A là Al, B là C
Al (Z=13) 1s22s22p63s23p1
C (Z = 6) 1s22s22p2
Câu 5. Cho 10 (g) một kim loại A thuộc nhóm IIA tc dụng hết với HCl thì thu được 5,6 (l) khí H2 (đkc). Tìm tên kim loại đó.
Đáp án: Ca
A + 2HCl → ACl2 + H2
Ta có : nA = nH2 = 5,6 / 22,4 = 0,25 (mol)
Suy ra: MA = 10 / 0,25 = 40 (g) . Nên A là Ca.
Câu 6. Hòa tan 20,2 (g) hỗn hợp 2 kim loại nằm ở hai chu kỳ liên tiếp thuộc phân nhóm chính nhóm I vô nước thu được 6,72 (l) khí (đkc) và dung dịch A. Tìm tên hai kim loại.
Đáp án: Na, K

Câu 7. Oxit cao nhất của nguyên tố R có công thức R2O5. Trong hợp chất khí với hidro, R chiếm 82,35 % về khối lượng. Tìm R.
Đáp án: N
Nguyên tố R có công thức R2O5 vậy R thuộc nhóm VA. Công thức hợp chất với hiđro là RH3.
Ta có % về khối lượng của hiđro là : %H = 100 – 82,35 = 17,65%
Áp dụng qui tắc tam suất :
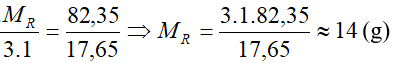
Vậy công thức của R là: N (nitơ)
Câu 8. Oxide cao nhất của nguyên tố X (thuộc nhóm IA) có chứa 74,194% nguyên tố X về khối lượng. Xác định tên nguyên tố X, viết cấu hình electron nguyên tử X.
Đáp án: Na: 1s22s22p63s1
Oxide cao nhất: X2O
%X = (2X/ 2X +16) .x100 = 74,194
→ X = 23 → X là Na
Cấu hình e: Na: 1s22s22p63s1
Câu 9. Oxide cao nhất của một nguyên tố là RO3. Nó có trong thành phần của oleum, được sử dụng trong sản xuất nhiều chất nổ. Trong hợp chất khí của R với hydrogen có 5,88% hydrogen về khối lượng. Xác định nguyên tố R.
Đáp án: S
Oxide cao nhất là RO3
→ Hợp chất khí của R với hydrogen là RH2
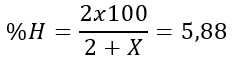
→ MR = 32
Vậy R là sulfur (S)
Câu 10. Kim loại R là nguyên tố nhóm IA trong bảng hệ thống tuần hoàn. Cho 9,2 gam kim loại R phản ứng hoàn toàn với một lượng nước dư, thu được dung dịch X và 4,958 lít khí H2 (đkc). Xác định tên kim loại R.
Đáp án: Na