Sơ đồ tư duy Hóa 10 Chương 5 Chân trời sáng tạo
Hướng dẫn vẽ Sơ đồ tư duy Hóa 10 Chương 5 Chân trời sáng tạo ngắn gọn, chi tiết nhất. Tổng hợp kiến thức Hóa 10 Chương 5 bằng Sơ đồ tư duy bám sát nội dung SGK Hóa học 10 Chân trời sáng tạo.
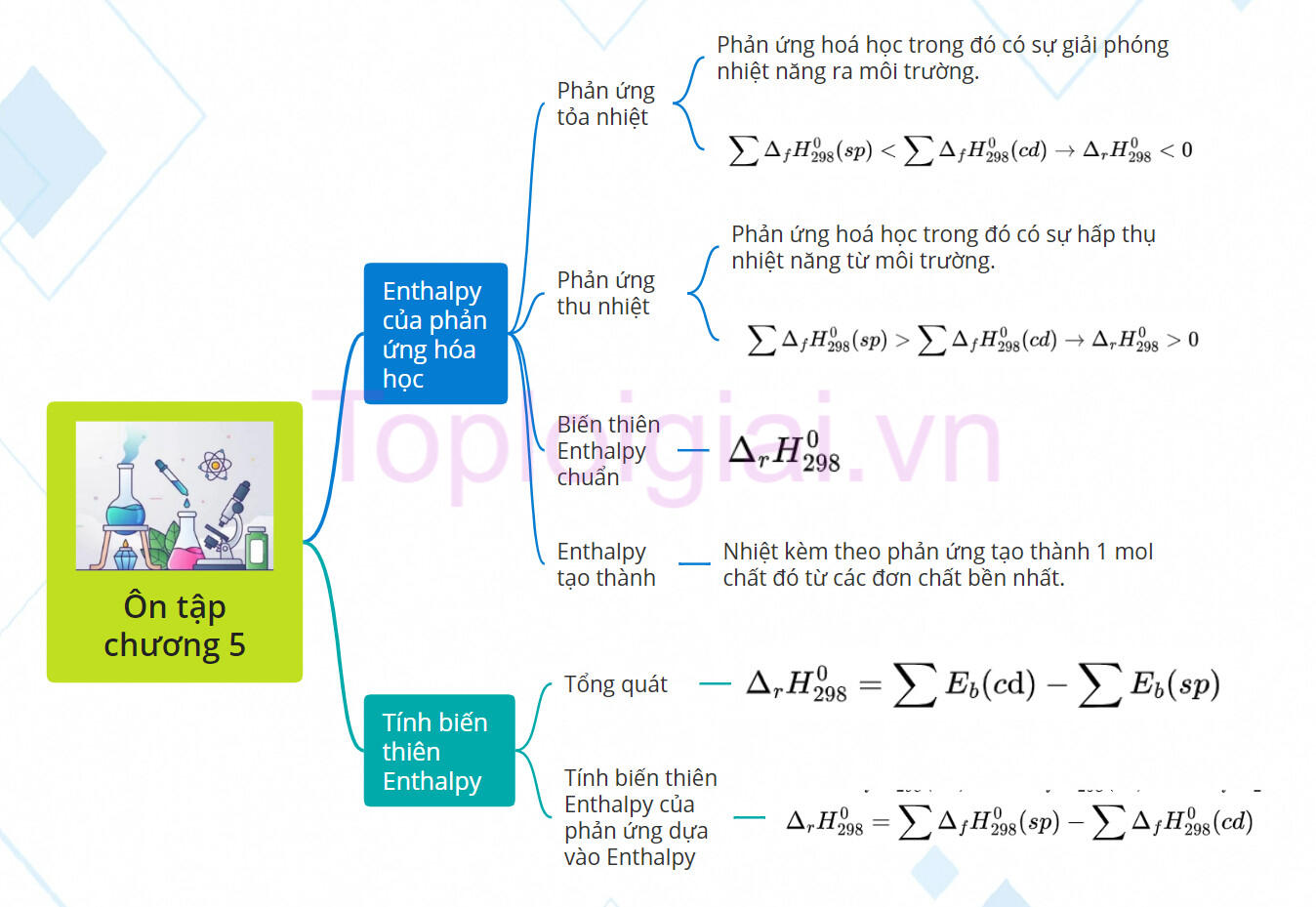
Sơ đồ tư duy Hóa 10 Chương 5 Chân trời sáng tạo
Tóm tắt lý thuyết Hóa 10 Chương 5 Chân trời sáng tạo
1. Enthalpy tạo thành và biến thiên Enthalpy của phản ứng hóa học
- Phản ứng tỏa nhiệt: Là phản ứng hoá học trong đó có sự giải phóng nhiệt năng ra môi trường.
- Phản ứng thu nhiệt: Là phản ứng hoá học trong đó có sự hấp thụ nhiệt năng từ môi trường.
- Biến thiên Enthalpy chuẩn của phản ứng:
+ Biến thiên enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của một phản ứng hoá học.
+ Kí hiệu:
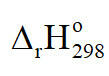
+ Điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và ở nhiệt độ không đổi, thường chọn nhiệt độ 25°C (hay 298 K).
- Enthalpy tạo thành (nhiệt tạo thành)
+ Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất.
- Ý nghĩa của dấu và giá trị ΔrH0298
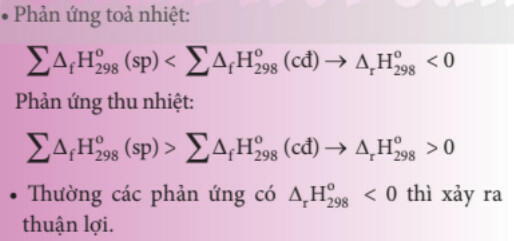
2. Tính biến thiên Enthalpy của phản ứng hóa học
- Tính biến thiên Enthalpy của phản ứng dựa vào năng lượng liên kết
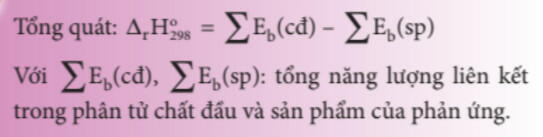
- Tính biến thiên Enthalpy của phản ứng dựa vào năng lượng tạo thành
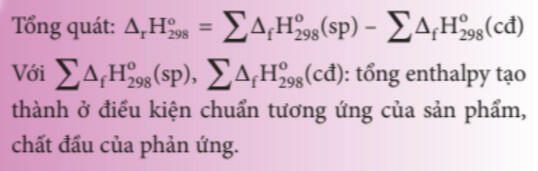
-----------------------------
Trên đây Toploigiai đã cùng các bạn Lập sơ đồ tư duy Hóa 10 Chương 5 Chân trời sáng tạo. Chúng tôi hi vọng các bạn đã có kiến thức hữu ích khi đọc bài viết này. Chúc các bạn học tốt!
