Sơ đồ tư duy Hóa 10 Chương 2 Chân trời sáng tạo
Hướng dẫn vẽ Sơ đồ tư duy Hóa 10 Chương 2 Chân trời sáng tạo ngắn gọn, chi tiết nhất. Tổng hợp kiến thức Hóa 10 Chương 2 bằng Sơ đồ tư duy bám sát nội dung SGK Hóa học 10 Chân trời sáng tạo.
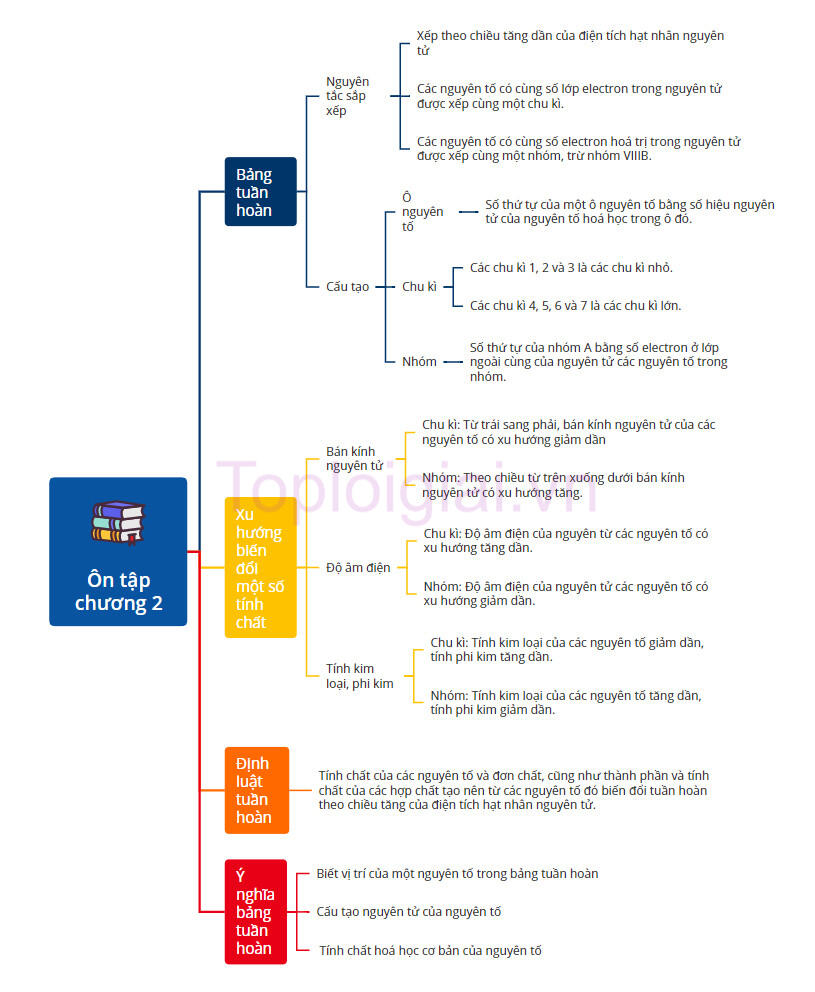
Sơ đồ tư duy Hóa 10 Chương 2 Chân trời sáng tạo
Tóm tắt lý thuyết Hóa 10 Chương 2 Chân trời sáng tạo
1. Cấu tạo bảng tuần hoàn các nguyên tố hóa học
a. Cấu tạo của bảng tuần hoàn
- Ô nguyên tố: Số thứ tự của một ô nguyên tố bằng số hiệu nguyên tử của nguyên tố hoá học trong ô đó.
- Chu kì: Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là chu kì. Số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố trong chu kì. Bảng tuần hoàn gồm 7 chu kì:
+ Các chu kì 1, 2 và 3 là các chu kì nhỏ.
+ Các chu kì 4, 5, 6 và 7 là các chu kì lớn.
- Nhóm: số thứ tự của nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong nhóm.
b. Phân loại nguyên tố dựa theo cấu hình electron và tính chất hoá học
- Dựa vào cấu hình electron: nguyên tố s, nguyên tố C, nguyên tố d và nguyên tố f.
- Dựa vào tính chất hoá học: nguyên tố kim loại, nguyên tố phi kim và nguyên tố khí hiếm.
c. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp cùng một chu kì.
- Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp cùng một nhóm, trừ nhóm VIIIB.
2. Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong một chu kì và nhóm
a. Bán kính nguyên tử
- Bán kính nguyên tử của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, từ trái sang phải, bán kính nguyên tử của các nguyên tố có xu hướng giảm dần
+ Trong một nhóm, theo chiều từ trên xuống dưới bán kính nguyên tử có xu hướng tăng.
b. Độ âm điện
- Độ âm điện của nguyên tử các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, độ âm điện của nguyên từ các nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, độ âm điện của nguyên tử các nguyên tố có xu hướng giảm dần.
c. Tính kim loại, tính phi kim
- Tính kim loại, tính phi kim của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần.
+ Trong một nhóm, tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.
d. Tính acid - base của oxide và hydroxide
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, tính acid của chúng tăng dần.
3. Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
a. Định luật tuần hoàn
Định luật tuần hoàn: Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
b. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
- Khi biết vị trí của một nguyên tố trong bảng tuần hoàn, có thể suy ra cấu tạo nguyên tử của nguyên tố đó và ngược lại. Từ đó, có thể suy ra những tính chất hoá học cơ bản của nó.
-----------------------------
Trên đây Toploigiai đã cùng các bạn Lập sơ đồ tư duy Hóa 10 Chương 2 Chân trời sáng tạo. Chúng tôi hi vọng các bạn đã có kiến thức hữu ích khi đọc bài viết này. Chúc các bạn học tốt!
