Sơ đồ tư duy Hóa 10 Chương 1 Chân trời sáng tạo
Hướng dẫn vẽ Sơ đồ tư duy Hóa 10 Chương 1 Chân trời sáng tạo ngắn gọn, chi tiết nhất. Tổng hợp kiến thức Hóa 10 Chương 1 bằng Sơ đồ tư duy bám sát nội dung SGK Hóa học 10 Chân trời sáng tạo.
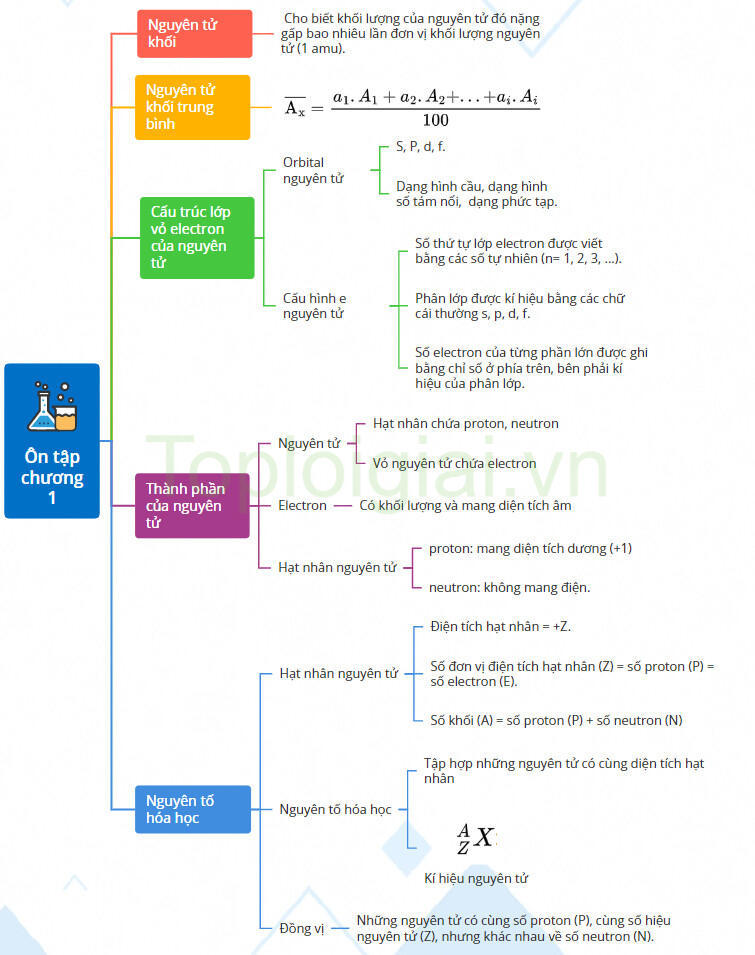
Sơ đồ tư duy Hóa 10 Chương 1 Chân trời sáng tạo
Tóm tắt lý thuyết Hóa 10 Chương 1 Chân trời sáng tạo
1. Thành phần của nguyên tử
a. Thành phần cấu tạo nguyên tử
- Nguyên tử gồm hạt nhân chứa proton, neutron và vỏ nguyên tử chứa electron.
b. Sự tìm ra electron
- Trong nguyên tử tồn tại một loại hạt electron (kí hiệu là e) có khối lượng và mang diện tích âm
+ Điện tích: qe = -1,602.10-19 C (coulomb).
=> Dùng làm điện tích đơn vị, điện tích của electron được quy ước là -1.
+ Khối lượng m = 9,11.10-28g.
c. Sự khám phá hạt nhân nguyên tử
- Nguyên tử có cấu tạo rỗng, gồm hạt nhân ở trung tâm và lớp vỏ là các electron chuyển động xung quanh hạt nhân.
- Nguyên tử trung hoà về điện: Số đơn vị diện tích dương của hạt nhân bằng số đơn vị điện tích âm của các electron trong nguyên tử.
d. Cấu tạo hạt nhân nguyên tử
- Hạt nhân nguyên tử gồm hai loại hạt:
+ proton: mang diện tích dương (+1)
+ neutron: không mang điện.
- Proton và neutron có khối lượng gần bằng nhau.
e. Kích thước và khối lượng nguyên tử
- Nếu xem nguyên tử như một quả cầu, trong đó các electron chuyển động rất nhanh xung quanh hạt nhân thì nguyên tử đó có đường kính khoảng 10-10 m và đường kính hạt nhân khoảng 10-14 m. Như vậy, đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng 10 000 lần.
- Khối lượng của nguyên tử gần bằng khối lượng hạt nhân do khối lượng của các electron không đáng kể so với khối lượng của proton và neutron.
2. Nguyên tố hóa học
a. Hạt nhân nguyên tử
Điện tích hạt nhân = +Z.
Số đơn vị điện tích hạt nhân (Z) = số proton (P) = số electron (E).
Số khối (A) = số proton (P) + số neutron (N)
b. Nguyên tố Hóa học
- Mỗi nguyên tố hóa học có một số hiệu nguyên tử.
- Nguyên tố hoá học là tập hợp những nguyên tử có cùng diện tích hạt nhân.
- Kí hiệu nguyên tử:

c. Đồng vị
- Các đồng vị của một nguyên tố hóa học là những nguyên tử có cùng số proton (P), cùng số hiệu nguyên tử (Z), nhưng khác nhau về số neutron (N).
- Số khối (A) khác nhau.
d. Nguyên tử khối và nguyên tử khối trung bình
- Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử (1 amu).
- Công thức tính nguyên tử khối trung bình của nguyên tố X:

3. Cấu trúc lớp vỏ electron của nguyên tử
a. Sự chuyển động của electron trong nguyên tử
- Orbital nguyên tử (Atomic Orbital, viết tắt AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà tại đó xác suất tìm thấy electron là lớn nhất (khoảng 90%).
- Một số AO thường gặp: S, P, d, f.
- Các AO có hình dạng khác nhau: AO s có dạng hình cầu, AO p có dạng hình số tám nổi, AO d và f có hình dạng phức tạp.
b. Lớp và phân lớp electron
- Trong nguyên tử, các electron được sắp xếp thành từng lớp (kí hiệu K, L, M, N, O, P,Q) từ gần đến xa hạt nhân, theo thứ tự từ lớp n = 1 đến n=7
- Các electron trên cùng một lớp có năng lượng gần bằng nhau.
- Mỗi lớp electron phân chia thành các phần lớp, được kí hiệu bằng các chữ cái viết thường: s, p, d, f. Các electron thuộc các phần lớp s, p, d và f được gọi tương ứng là các electron s, p, dvà f.
- Các phân lớp s, p, d và f lần lượt có các số AO tương ứng 1, 3, 5 và 7.
- Các electron trên cùng một phần lớp có năng lượng bằng nhau. Với 4 lớp đầu (1, 2, 3, 4) số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó.
c. Cấu hình electron nguyên tử
- Nguyên lí vững bền
+ Ở trạng thái cơ bản, các electron trong nguyên tử chiếm lần lượt những orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p...
- Nguyên lí Pauli
+ Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau.
=> Số electron tối đa trong lớp n là 2n (n<4).
- Quy tắc Hund
+ Trong cùng một phần lớn chưa bão hoà, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa.
- Cấu hình electron nguyên tử phải được viết theo thứ tự các lớp electron và phân lớp trong mỗi lớp. Trong đó:
+ Số thứ tự lớp electron được viết bằng các số tự nhiên (n = 1, 2, 3, ...).
+ Phân lớp được kí hiệu bằng các chữ cái thường s, p, d, f.
+ Số electron của từng phần lớn được ghi bằng chỉ số ở phía trên, bên phải kí hiệu của phân lớp.
-----------------------------
Trên đây Toploigiai đã cùng các bạn Lập sơ đồ tư duy Hóa 10 Chương 1 Chân trời sáng tạo. Chúng tôi hi vọng các bạn đã có kiến thức hữu ích khi đọc bài viết này. Chúc các bạn học tốt!
