Tính biến thiên enthalpy của phản ứng đốt cháy 1 mol ethanol và 1 mol khí gas
Hướng dẫn cách tính biến thiên enthalpy của phản ứng đốt cháy 1 mol ethanol và 1 mol khí gas và một số dạng bài tập về biến thiên Enthalpy giúp các bạn biết cách giải các bài tập Hóa học 10.
Mục lục nội dung
Tính biến thiên enthalpy của phản ứng đốt cháy 1 mol ethanol
Phương trình phản ứng đốt cháy 1 mol ethanol là:
C2H5OH + 3O2 → 2CO2 + 2H2O
Biến thiên enthalpy của phản ứng đốt cháy 1 mol ethanol là:
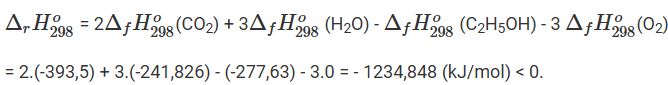
Vậy phản ứng tỏa nhiệt
Tính biến thiên enthalpy của phản ứng đốt cháy 1 mol khí gas
Khí gas chủ yếu gồm Propane (C3H8) và Butane (C4H10)
Biến thiên enthalpy của phản ứng đốt cháy 1 mol propane
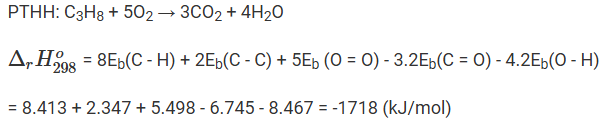
Biến thiên enthalpy của phản ứng đốt cháy 1 mol butane

Biến thiên enthalpy của phản ứng đốt cháy 1 mol khí gas
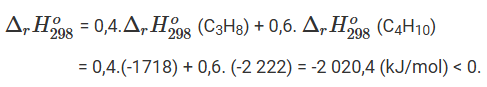
Vậy phản ứng toả nhiệt
Xuất bản : 07/07/2022 - Cập nhật :
03/07/2024
Câu hỏi thường gặp
Tìm Kiếm Bài Viết
