Soạn KHTN 8 Bài 4: Dung dịch và nồng độ
Hướng dẫn Soạn KHTN 8 Bài 4: Dung dịch và nồng độ ngắn gọn, hay nhất theo chương trình Sách mới.
Bài 4: Dung dịch và nồng độ
Lý thuyết Khoa học tự nhiên 8 Kết nối tri thức Bài 4: Dung dịch và nồng độ
Sơ đồ tư duy Khoa học tự nhiên 8 Kết nối tri thức Bài 4: Dung dịch và nồng độ
Mở đầu trang 20 Bài 4 KHTN 8: Các dung dịch thường có ghi kèm theo nồng độ xác định như nước muối sinh lí 0,9%, sulfuric acid 1 mol/L, … Vậy nồng độ dung dịch là gì?
Trả lời:
- Có hai loại nồng độ dung dịch để định lượng một dung dịch đặc hay loãng thường dùng là nồng độ phần trăm và nồng độ mol.
+ Nồng độ phần trăm (kí hiệu C%) của một dung dịch cho biết số gam chất tan có trong 100 gam dung dịch.
+ Nồng độ mol (kí hiệu CM) của một dung dịch cho biết số mol chất tan có trong 1 lít dung dịch.
Hoạt động trang 20 KHTN 8: Nhận biết dung dịch, chất tan và dung môi
Chuẩn bị: nước, muối ăn, sữa bột (hoặc bột sắn, bột gạo, …), copper(II) sulfate; cốc thuỷ tinh, đũa khuấy.
Tiến hành:
- Cho khoảng 20 mL nước vào bốn cốc thuỷ tinh, đánh số (1), (2), (3) và (4).
- Cho vào cốc (1) 1 thìa (khoảng 3g) muối ăn hạt, cốc (2) 1 thìa copper(II) sulfate, cốc (3) 1 thìa sữa bột, cốc (4) 4 thìa muối ăn. Khuấy đều khoảng 2 phút, sau đó để yên.
Nhận biết dung dịch, chất tan và dung môi
Quan sát và trả lời câu hỏi:
1. Trong các cốc (1), (2), (3), cốc nào chứa dung dịch? Dựa vào dấu hiệu nào để nhận biết? Chỉ ra các chất tan, dung môi trong dung dịch thu được.
2. Phần dung dịch ở cốc (4) có phải là dung dịch bão hoà ở nhiệt độ phòng không? Giải thích.
Trả lời:
1. Cốc (1) và cốc (2) chứa dung dịch. Do hai cốc này là hỗn hợp đồng nhất của chất tan và dung môi.
+ Cốc (1): chất tan là muối ăn; dung môi là nước.
+ Cốc (2): chất tan là copper(II) sulfate; dung môi là nước.
2. Phần dung dịch ở cốc (4) là dung dịch bão hoà ở nhiệt độ phòng. Do ở điều kiện này dung dịch không thể hoà tan thêm chất tan được nữa.
Câu hỏi trang 20 KHTN 8: Hãy nêu cách pha dung dịch bão hoà của sodium carbonate (Na2CO3) trong nước.
Trả lời:
Chuẩn bị một cốc nước cho dần dần và liên tục muối sodium carbonate (Na2CO3) vào trong cốc nước, khuấy nhẹ đến bao giờ không thể hòa tan thêm muối nữa thì ta thu được dung dịch sodium carbonate (Na2CO3) bão hòa
Câu hỏi 1 trang 21 KHTN 8: Ở nhiệt độ 25 oC, khi cho 12 gam muối X vào 20 gam nước, khuấy kĩ thì còn lại 5 gam muối không tan. Tính độ tan của muối X.
Trả lời:

Câu hỏi 2 trang 21 KHTN 8: Ở 18oC, khi hoà tan hết 53 gam Na2CO3 trong 250 gam nước thì được dung dịch bão hoà. Tính độ tan của Na2CO3 trong nước ở nhiệt độ trên.
Trả lời:
Độ tan của Na2CO3 trong nước ở 18oC là:
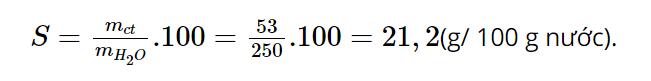
Câu hỏi 1 trang 22 KHTN 8: Tính khối lượng H2SO4 có trong 20 gam dung dịch H2SO4 98%
Trả lời:

Câu hỏi 2 trang 22 KHTN 8: Trộn lẫn 2 lít dung dịch urea 0,02 M (dung dịch A) với 3 lít dung dịch urea 0,1 M (dung dịch B), thu được 5 lít dung dịch C.
a) Tính số mol urea trong dung dịch A, B và C.
b) Tính nồng độ mol của dung dịch C. Nhận xét về giá trị nồng độ mol của dung dịch C so với nồng độ mol của dung dịch A và B.
Trả lời:
- Nồng độ mol được xác định bằng biểu thức:
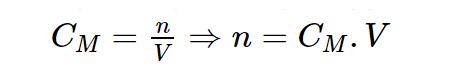
a) Số mol urea trong dung dịch A là: n(A) = 0,02 . 2 = 0,04 (mol).
- Số mol urea trong dung dịch B là: n(B) = 0,1 . 3 = 0,3 (mol).
- Số mol urea trong dung dịch C là: n(C) = 0,04 + 0,3 = 0,34 (mol).
b) Nồng độ mol của dung dịch C là:
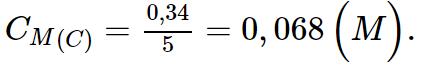
=> Ta có: Nồng độ mol của dung dịch A < Nồng độ mol của dung dịch C < Nồng độ mol của dung dịch B.
Hoạt động trang 22 KHTN 8: Pha 100 gam dung dịch muối ăn nồng độ 0,9%
Chuẩn bị: muối ăn khan, nước cất; cốc thuỷ tinh, cân, ống đong.
Tiến hành:
- Xác định khối lượng muối ăn (m1) và nước (m2) dựa vào công thức:
C%=mct/mdd.100(%)
- Cân m1 gam muối ăn rồi cho vào cốc thuỷ tinh.
- Cân m2 gam nước cất, rót vào cốc, lắc đều cho muối tan hết.
Trả lời câu hỏi:
1. Tại sao phải dùng muối ăn khan để pha dung dịch?
2. Dung dịch muối ăn nồng độ 0,9% có thể được dùng để làm gì?
Trả lời:
1. Dùng muối ăn khan pha dung dịch để xác định được chính xác khối lượng chất tan.
2. Dung dịch muối ăn nồng độ 0,9% có thể được dùng với các mục đích khác nhau như:
- Làm thuốc nhỏ mắt, thuốc nhỏ mũi, thuốc nhỏ tai, súc miệng và rửa vết thương, giúp làm sạch, loại bỏ chất bẩn, vi khuẩn, ngăn ngừa viêm nhiễm…
- Dùng làm dịch truyền vào cơ thể để điều trị tình trạng mất nước do một số bệnh lí gây ra như đái tháo đường, viêm dạ dày …
>>> Xem toàn bộ: Soạn KHTN 8 Kết nối tri thức
-------------------------------------
Trên đây Toploigiai đã cùng các bạn Trả lời câu hỏi KHTN 8 Kết nối tri thức Bài 4: Dung dịch và nồng độ trong bộ SGK Kết nối tri thức theo chương trình sách mới. húc các bạn học tốt!
