NaCl ra Na (NaCl → Na + Cl2) - PTHH, cách thực hiện, hiện tượng
Phương trình hóa học NaCl ra Na (NaCl → Na + Cl2) và cách thực hiện, hiện tượng của phản ứng. Kết hợp với các bài tập vận dụng về điện phân nóng chảy NaCl ra Na.
Phương trình hóa học NaCl ra Na
Để thu được Na từ NaCl, người ta tiến hành điện phân nóng chảy dung dịch NaCl có màng ngăn. Cách thực hiện như sau:
Quá trình điện phân được tiến hành bằng cách cho dòng điện chạy qua dung dịch muối NaCl để tạo ra phản ứng hóa học. Khi phản ứng xảy ra sẽ tách dung dịch muối NaCl thành Na+ và Cl–. Trong đó các ion Na+ sẽ di chuyển về hướng cực âm (catot) và Cl– sẽ di chuyển về cực dương (anot).
PTHH NaCl ra Na như sau:
2NaCl đpnc → 2Na + Cl2
Giải thích hiện tượng NaCl ra Na
- Ở cực dương (Anot): Xảy ra sự oxi hóa
2Cl– → Cl2 + 2e
- Ở cực âm (Catot): Xảy ra sự khử
2H2O + 2e → H2 + 2OH-
Phương trình điện phân đầu tiên:
2NaCl + 2H2O (dpdd) → 2NaOH + H2 + Cl2
Thí dụ: K (-) NaCl n/c A (+)
Na+ + e → Na 2Cl- - 2e → Cl2
Do quá trình điện phân có sử dụng màng ngăn xốp, tác dụng của mang năng này là ngăn NaOH xảy ra phản ứng được với khí Clo sinh ra. Do đó, ta có Phương trình hóa học NaCl ra Na nhờ điện phân nóng chảy là:
2NaCl đpnc → 2Na + Cl2
Sau khi điện phân, sản phẩm thu được là Na và Cl2.
Mở rộng kiến thức về NaCl
* Nguồn gốc:
Phần lớn muối có nguồn gốc trên đất liên, nhưng muối NaCl cũng xuất phát từ miệng núi lửa hay đá biển.
* Tính chất vật lý: Muối NaCl là chất rắn kết tinh không màu hoặc màu trắng
* Tính chất hoá học:
- NaCl là chất điện li mạnh, phân li hoàn toàn trong nước và tạo ra các ion âm và dương.
- NaCL là muối của bazo khá mạnh và axit mạnh nên nó mang tính trung tính, nên tương đối trơ về mặt hoá học
- Điện phân NaCl sẽ giải phóng kim loại và phim kim như điện phân NaCl nóng chảy tạo thành khí clo và natri kim loại
- Muối NaCl tác dụng với axit,
* Ứng dụng: Muối được ứng dụng nhiều trong nông nghiệp, trong thực phẩm, trong y tế và cả cuộc sống hàng ngày của chúng ta.
Bài tập vận dụng về điện phân NaCl ra Na
Câu 1. Điện phân dung dịch chứa 23,4 gam muối ăn (với điện cực trơ, màng ngăn xốp), thu được 2,5 lít dung dịch có pH=13. Phần trăm muối ăn bị điện phân là
A. 62,5%.
B. 65%.
C. 70%.
D. 80%.
Giải
Đáp án: A
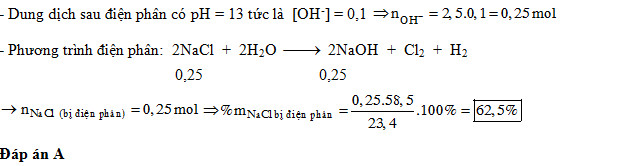
Câu 2. Câu 4. Khi điện phân NaCl nóng chảy (điện cực trơ), tại anot xảy ra
A. sự khử ion Cl-.
B. sự oxi hoá ion Cl-.
C. sự oxi hoá ion Na+.
D. sự khử ion Na+.
Giải
Đáp án B
Trong quá trình điện phân,ion Na+ di chuyển về phía catot (cực âm) và ion Cl- di chuyển về phía anot (cực âm). Na+ có tính oxi hóa nên bị khử.
Vật tại catot xảy ra sự khử ion Na+, anot là sự oxi hoá ion Cl-
Chú ý: Tổng quát với quá trình điện phân, tại catot diễn ra sự khử và tại anot diễn ra sự oxi hóa.
Câu 3. Khi điện phân điện cực trơ có màng ngăn dung dịch hỗn hợp gồm NaCl và CuSO4 đến khi NaCl và CuSO4 đều hết nếu dung dịch sau điện phân hoà tan được Fe và sinh khí thì dung dịch sau điện phân chắc chắn chứa
A. CuCl2
B. CuSO4
C. HCl, CuSO4
D. H2SO4
Giải:
Đáp án D
Ta thấy khi điện phân hết NaCl và CuSO4 thì chỉ có Cu2+ và Cl- bị điện phân hết tạo Cu và Cl2. Mà dung dịch sau điện phân hòa tan được Fe và sinh khí => dung dịch sau điện phân chứa axit
=> dung dịch chắc chắn chứa H2SO4 (vì SO42- không bị điện phân)
Câu 4. Điện phân NaCl nóng chảy bằng điện cực trơ, ở catot thu được
A. Cl2.
B. Na.
C. NaOH.
D. H2.
Giải:
Đáp án B
Trong quá trình điện phân,ion Na+ di chuyển về phía catot (cực âm) và ion Cl- di chuyển về phía anot (cực âm). Na+ có tính oxi hóa nên bị khử.
Vật tại catot xảy ra sự khử ion Na+ => thu được Na
Câu 5. Trong quá trình điện phân dung dịch NaCl ở cực âm xảy ra
A. Sự khử phân tử nước
B. Sự oxi hoá ion Na+
C. Sự oxi hoá phân tử nước
D. Sự khử ion Na+
Giải:
Đáp án A
Trong quá trình điện phân dung dịch NaCl ở cực âm xảy ra Sự khử phân tử nước
Điện phân dung dịch NaCl:
Ở cực âm (catot): trên bề mặt của cực âm có các ion Na+ và phân tử H2O. Ở đây xảy ra sự khử các phân tử
H2O: 2H2O + 2e → H2 + 2OH-.
Ở cực dương (anot): trên bề mặt của cực dương có các ion Cl- và phân tử H2O.Ở đây xảy ra sự oxi hóa các ion
Cl-: 2Cl- → Cl2 + 2e
Câu 6. Điện phân NaCl nóng chảy với điện cực trơ ở catot thu được
A. Cl2
B. NaOH
C. Na
D. HCl
Giải
Đáp án C
Điện phân dung dịch NaCl:
Ở cực âm (catot): trên bề mặt của cực âm có các ion Na+ và phân tử H2O.
Ở đây xảy ra sự khử các phân tử H2O:
2H2O + 2e → H2 + 2OH-.
Ở cực dương (anot): trên bề mặt của cực dương có các ion Cl- và phân tử H2O.
Ở đây xảy ra sự oxi hóa các ion Cl-:
2Cl- → Cl2 + 2e có các ion Cl- và phân tử H2O.
Câu 7. Điện phân dung dịch NaCl có màng ngăn nhận định nào dưới đây là đúng?
A. Ở catot xảy ra sự khử ion kim loại Natri.
B. Ở anot xảy ra sự oxi hóa H2O.
C. Ở anot sinh ra khí H2.
D. Ở catot xảy ra sự khử nước.
Giải:
Đáp án D
Do ion Na+ không bị điện phân trong dung dịch ⇒ tại catot chỉ xảy ra sự khử H2O.
