Alpha amino axit là gì? (Công thức, tính chất, ví dụ)
Tìm hiểu chi tiết về khái niệm Alpha amino axit cùng công thức hóa học, tính chất vật lý, hóa học và ví dụ minh họa về Alpha amino axit.
1. Alpha amino axit là gì?
Alpha amino axit là amino axit mà nhóm amino (-NH2) gắn trực tiếp với cacbon ở vị trí số 2.
Công thức chung: (H2N)x–R–(COOH)y
Quan trọng nhất chính là các α – aminoaxit (hay các aminoaxit có các nhóm COOH và NH2 cùng gắn vào 1 nguyên tử C – C số 2). Nhìn chung các aminoaxit thiên nhiên đều là các α – aminoaxit.
Cấu trúc chung của một phân tử alpha amino axit, với nhóm amin ở bên trái và nhóm axit cacboxylic. Trong hóa sinh, thuật ngữ này còn để chỉ axit amin: những axit amin mà trong đó nhóm amin và cacboxylic gắn vào cùng một cacbon, nên gọi là α–cacbon
Phần dư còn lại của một alpha amino axit là phần mà sau khi đã loại bỏ phân tử nước (một H+ ra khỏi nitơ và một OH− khỏi cacbon) và tạo thành liên kết peptit.
2. Ví dụ về alpha amino axit
Hầu hết, các amino acid thiên nhiên đều là các alpha amino acid. Một số ví dụ về amino acid tự nhiên như sau:
NH2-CH2-COOH: Acid aminoaxetic với tên thường gọi là glixin hay glicocol.
CH3-CH(NH2)-COOH: Acid aminopropionic với tên thường gọi là alanin
HOOC-CH2-CH2-CH(NH2)-COOH: Acid a-amino glutaric với tên thường gọi là axit glutamic.
(CH3)2CHCH(NH2)COOH: Acid a-amino isovaleric với tên thường gọi là valin.
NH2(CH2)4CH(NH2)COOH: Acid α,ε-diaminocaproic với tên thường gọi là lysine.
HO-C6H4-CH2-CH(NH2)-COOH: Acid a-amino-ẞ hay p-hydroxyphenyl với tên thường gọi là propanoic hay tyrosine.
Một số ví dụ về alpha amino axit như sau:
3. Tính chất của alpha amino axit
Vì alpha amino axit là một amino axit nên mang đầy đủ tính chất của amino axit đó là:
* Tính chất vật lí:
- Alpha amino axit là một chất rắn, tồn tại dưới dạng tinh thể không màu và có vị hơi ngọt.
- Alpha amino axit có nhiệt độ nóng chảy cao và dễ tan trong nước.
>>> Tham khảo: Đồng phân amino axit và cách gọi tên
* Tính chất hóa học
- Sự phân li trong dung dịch
H2N-CH2-COOH ↔ H3N+-CH2-COO-
(ion lưỡng cực)
- Có tính lưỡng tính
+ Tính axit: Tác dụng với bazơ mạnh tạo ra muối và nước:
NH2-CH2-COOH + KOH → NH2-CH2-COOK + H2O
Chú ý: Sử dụng phương pháp tăng giảm khối lượng khi giải bài tập.
+ Tính bazơ: Tác dụng với axit mạnh tạo muối.
NH2-CH2-COOH + HCl → ClNH3 – CH2 – COOH
Chú ý: Khi giải bài tập cần sử dụng phương pháp tăng giảm khối lượng và định luật bảo toàn khối lượng.
- Phản ứng este hoá
NH2-CH2-COOH + ROH → NH2-CH2-COOR + H2O (khí HCl)
4. Một số bài tập về alpha amino axit
Bài 1: Este A được điều chế từ α-amino axit và ancol metylic. Tỉ khối hơi của A so với hiđro bằng 44,5. Công thức cấu tạo của A là:
A. H2NCH2CH(NH2)COOCH3
B. H2NCH2COOCH3
C. H2NCH2CH2COOH
D. CH3CH(NH2)COOCH3
Giải:
Chọn đáp án B
dA/H2 = 44,5 ⇒ MA = 89
⇒ CTPT của A là C3H7NO2.
mà A là este được điều chế từ α-amino axit và ancol metylic
⇒ cấu tạo duy nhất thỏa mãn của A là H2NCH2COOCH3
Bài 2: α–aminoaxit X chứa một nhóm –NH2. Cho 10,3 gam X tác dụng với axit HCl (dư), thu được 13,95 gam muối khan. Công thức cấu tạo thu gọn của X là
A. H2NCH2COOH.
B. H2NCH2CH2COOH.
C. CH3CH2CH(NH2)COOH.
D. CH3CH(NH2)COOH.
Giải:
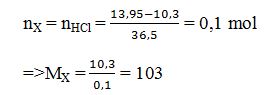
Dựa vào đáp án ⇒ X là: CH3CH2CH(NH2)COOH
→ Đáp án C
Bài 3: Đốt cháy 0.2 mol hợp chất amino axit A được lấy từ thiên nhiên, thu được 26.4 g khí CO2, 12.6 gam hơi H2O và 2.24 lit khí N2. Nếu đốt cháy 1 mol A cần 3.75 mol O2. Công thức cấu tạo của X là:
A. H2NCH(C2H5)COOH
B. H2NCH2COOH
C. H2NCH(CH3)COOH
D. H2NCH2CH2COOH.
Giải:
nCO2=0,6mol; nH2O=0,7mol; nN2=0,1mol;
Áp dụng định luật bảo toàn nguyên tố ta có:
BTNT C → số C (amino axit) = 3
BTNT H → số H (amino axit) = 7
Nếu đốt cháy 1 mol A cần 3,75 mol O2
→ Đốt cháy 0,2 mol A cần 0,75 mol O2
BTNT O: nO(aminoaxit)+2nO2=2nCO2+nH2O
→ nO(amino axit) = 0,4 mol → số O (amino axit) = 2
BTNT N → số N (amino axit) = 1
Vậy amino axit A có công thức phân tử: C3H7O2N
Mà A được lấy từ thiên nhiên nên A là α – amino axit
→ Công thức cấu tạo: H2NCH(CH3)COOH.
Chọn đáp án C.
Bài 4: Cho 0.15 mol alanin vào 175ml dung dịch NaOH 2M, thu được dung dịch A. Cho HCl dư vào dung dịch. Sau khi các phản ứng hoàn toàn, số mol HCl đã phản ứng là:
A. 0.7 mol
B. 0.5 mol
C. 0.65 mol
D. 0.55 mol
Giải:
n NaOH = 0.175 x2 = 0.35 mol.
Alanin ( H2N- CH(CH3)- COOH) trong phân tử chứa 1 nhóm -NH2 và 1 nhóm -COOH.
→ n – NH2 = n Alanin = 0.15 mol.
Sử dụng công thức tính nhanh:
n HCl pư= n NaOH + n- NH2 = 0.35 + 0.15 = 0.5 mol
Vậy đáp án đúng là B.
