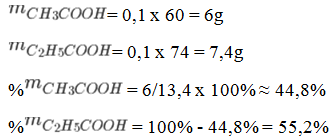Bài 45. Axit Axetic
Bài 45. Axit axetic
Bài 45.1 trang 54 SBT Hóa học 9
a) ? + ? → CH3COONa + H2
b) ? + ? → CH3COONa + H2O + CO2
c) CH3COOH + ? → (CH3COO)2Ca + ? + ↑
d) ? + Mg → (CH3COO)2Mg + ↑
e) ? + CuSO4 → (CH3COO)2Cu + ↓
Lời giải
a) 2CH3COOH + 2Na → CH3COONa + H2
b) 2CH3COOH + Na2CO3 → CH3COONa + H2O + CO2
c) CH3COOH + ? → (CH3COO)2Ca + ? + CO2↑
d) 2CH3COOH + Mg → (CH3COO)2Mg + H2↑
e) (CH3COO)2Ba + CuSO4 → (CH3COO)2Cu + BaSO4↓
Bài 45.2 trang 54 SBT Hóa học 9
Nhận định nào sau đây đúng?
-
Những chất có nhóm -OH hoặc -COOH tác dụng được với NaOH.
-
Những chất có nhóm -OH tác dụng được với NaOH.
-
Những chất có nhóm -COOH tác dụng được với NaOH nhưng không tác dụng với Na.
-
Những chất có nhóm -OH tác dụng được với Na, còn những chất có nhóm -COOH vừa tác dụng được với Na vừa tác dụng được với NaOH.
Lời giải
Đáp án D.
Bài 45.3 trang 54 SBT Hóa học 9
Hỗn hợp X gồm axit axetic và rượu etylic. Cho m gam hỗn hợp X tác dụng hết với Na thấy thoát ra 0,336 lít khí H2 ở đktc.
Mặt khác cho m gam X tác dụng vừa đủ với dung dịch NaOH 0,1M thì hết 200 ml.
a) Hãy xác định m.
b) Tính phẩn trăm khối lượng của mỗi chất có trong m gam hỗn hợp.
Lời giải
a) Gọi số mol axit axetic trong hỗn hợp là x.
Số mol rượu etylic trong hỗn hợp là y.
Phương trình hoá học của phản ứng khi X tác dụng với Na:
2CH3COOH + 2Na → 2CH3COONa + H2↑
x mol x/2 mol
2C2H5OH + 2Na → 2C2H5ONa + H2
y mol y/2 mol
Ta có: ![]() = x/2 + y/2
= x/2 + y/2
Theo đề bài: ![]() = 0,336/22,4 = 0,015 mol
= 0,336/22,4 = 0,015 mol
Vậy x/2 + y/2 = 0,015 → x + y = 0,03 mol
Phương trình hoá học của phản ứng khi X tác dụng với NaOH:
CH3COOH + NaOH → CH3COONa + H20
x x
Theo đề bài số mol NaOH phản ứng là 0,1 X 0,2 = 0,02 (mol).
Vậy x = 0,02 (mol) và y = 0,03 - x = 0,03 - 0,02 = 0,01 (mol).
→ Khối lượng hỗn hợp là m = 0,02 x 60 + 0,01 x 46 = 1,2 + 0,46 = 1,66 (gam)
b) % khối lượng CH3COOH: 1,2/1,66 x 100% = 72,29%
% khối lương C2H5OH: 0,46/1,66 x 100% = 27,71%
Bài 45.4 trang 55 SBT Hóa học 9
Chất hữu cơ A chứa các nguyên tố C, H, O có khối lượng mol phân tử là 60 gam/mol. Đốt cháy hoàn toàn 3 gam A rồi cho sản phẩm thu được qua bình 1 đựng H2SO4 đặc, sau đó qua bình 2 đựng dung dịch Ca(OH)2 dư. Sau phản ứng thấy khối lượng bình 1 tăng thêm 1,8 gam, ở bình 2 có 10 gam kết tủa.
a) Hãy xác định công thức phân tử của A.
b) Viết các công thức cấu tạo có thể có của A, biết A làm quỳ tím chuyển sang màu đỏ.
Lời giải
a) Chất A chứa C, H, O khi đốt cháy sẽ sinh ra CO2 và H2 Khi qua bình 1 đựng H2SO4 đặc thì H20 bị hấp thụ. Vậy khối lượng H20 là 1,8 gam. Qua bình 2 có phản ứng:
Ca(OH)2 + CO2 → CaCO3↓+ H20
Theo phương trình: ![]() = 10/100 = 0,1 mol
= 10/100 = 0,1 mol
Vậy khối lượng cacbon có trong 3 gam A là 0,1 x 12 = 1,2 (gam).
Khối lượng hiđro có trong 3 gam A là 0,1 x 2 = 0,2 (gam).
Khối lượng oxi có trong 3 gam A là 3 - 1,2 - 0,2 = 1,6 (gam).
Gọi công thức phân tử của A là CxHyOz.
Ta có:
60 gam A → 12x gam C → y g H → 16z gam O
3 gam → 1,2 gam → 0,2 gam → 1,6 gam
x = 1,2x60/36 = 2; y = 60x0,2/3 = 4
z = 1,6x60/48 = 2
→ Công thức phân tử của A là C2H4O2.
b) Vì A làm quỳ tím chuyển sang màu đỏ nên A là một axit → Trong phân tử A có nhóm -COOH.
Vậy công thức cấu tạo của A là CH3-COOH.
Bài 45.5 trang 55 SBT Hóa học 9
Tính khối lượng dung dịch axit axetic thu được khi lên men 50 lít rượu etylic 4°. Biết khối lượng riêng của rượu etylic là 0,8 g/ml và hiệu suất của quá trình lên men là 92%.
Lời giải
Trong 50 lít rượu etylic 4° có 50/100 x 4 = 2(l) rượu nguyên chất
Vậy khối lượng rượu etylic có trong 50 lít rượu 4° là:
2 x 1000 x 0,8 = 1600 (gam)
Vì hiệu suất đạt 92% nên khối lượng rượu đã lên men là 1600x92/100 = 1472 (gam)
Số mol rươu đã lên men là 1472/46 = 32 (mol)
Phản ứng lên men:
C2H5OH + O2 → CH3COOH + H2O
Vậy khối lượng của CH3COOH tạo ra là:
60 x 32 = 1920 (gam).
Bài 45.6 trang 55 SBT Hóa học 9
Cho 9,7 gam hỗn hợp X gồm axit axetic và axit A có công thức CmH2m+1COOH tác dụng với dung dịch NaOH 1M thì vừa hết 150 ml.
a) Xác định công thức phân tử của A. Biết tỉ lệ số mol của axit axetic và A trong hỗn hợp là 2 : 1
b) Tính thành phần % khối lượng của mỗi chất trong hỗn hợp X.
c) Viết công thức cấu tạo của A.
Lời giải
a) Gọi số mol của CH3COOH trong hỗn hợp là 2x.
Vậy số mol của CmH2m + 1COOH trong hỗn hợp là x.
Ta có: 2x x 60 + x(14m + 46) = 9,7 (1)
Phương trình hoá học của phản ứng giữa X với NaOH:
CH3COOH + NaOH → CH3COONa + H20
CmH2m + 1 COOH + NaOH → CmH2m + 1COONa + H2O
Vậy x = 0,05 → số mol CH3COOH là 2x = 2. 0,05 = 0,1.
Thay x = 0,05 vào phương trình (1), ta có:
2 x 0,05 x 60 + 0,05(14m + 46) = 9,7.
→ 0,7m + 6 + 2,3 = 9,7.
→ m = 2.
Công thức của axit phải tìm là C2H5COOH.
b) Khối lượng của axit axetic là 60 x 0,1 = 6 (gam).
Phần trăm khối lượng của CH3COOH là: 6/9,7 x 100% ≈ 61,86%
Phần trăm khối lượng của C2H5COOH là: 100% -61,86% = 38,14%
c) Công thức cấu tạo của A:
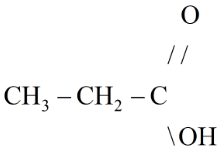
Bài 45.7 trang 55 SBT Hóa học 9
Cho 30 gam axit axetic tác dụng với 92 gam rượu etylic có mặt H2S04 đặc. Hãy tính số gam etyl axetat tạo thành, biết hiệu suất của phản ứng là 60%.
Lời giải
Phương trình hoá học của phản ứng giữa CH3COOH và C2H5OH:
![]()
Số mol CH3COOH = 30/60 = 0,5 mol
Số mol C2H5OH = 92/46 = 2 mol
Vậy theo phương trình hoá học, số mol C2H5OH dư.
Giả sử hiệu suất đạt 100% => netyl axetat = naxit axetic = 0,5 mol.
Vì hiệu suất đạt 60% nên số mol etyl axetat thu được là: 0,5 x 60/100 = 0,3 mol
Khối lượng etyl axetat thu được là 0,3 x 88 = 26,4 (gam)
Bài 45.8 trang 55 SBT Hóa học 9
Hỗn hợp X gồm hai axit hữu cơ có công thức tổng quát CnH2n+1COOH với n ≥0. Cho 13,4 gam hỗn hợp X tác dụng với dung dịch NaOH 1M thì vừa hết V ml. Cô cạn dung dịch sau phản ứng thu được 17,8 gam hỗn hợp muối khan.
- Xác định công thức phân tử của hai axit. Biết số mol của chúng trong hỗn hợp bằng nhau.
- Tính V và thành phần % khối lượng của mỗi axit trong hỗn hợp.
Lời giải
Phương trình hoá học:
CnH2n+1COOH + NaOH → CnH2n+1COONa + H20
Gọi số mol của hai axit trong hỗn hợp là x.
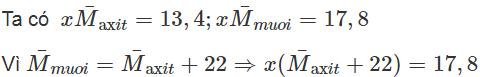
13,4 + 22x = 17,8 => x = 0,2 => số mol của mỗi axit trong hỗn hợp là 0,1
Ta có công thức của 2 axit là CaH2a+1COOH (0,1 mol)
CbH2b+1COOH (0,1 mol)
Vậy: (14a + 46)0,1 + (14b + 46)0,1 = 13,4
=> 14a + 14b = 42 => a + b = 3
a = 1; b = 2 → CH3COOH và C2H5COOH