Đề thi Học kì 2 Hóa 8 có đáp án - Đề 21
Đề thi Học kì 2 Hóa 8 có đáp án - Đề 21
ĐỀ BÀI
Câu 1: (2,5 điểm)
- Nêu tính chất vật lí và tính chất hoá học của oxi.
- Trong phòng thí nghiệm khí oxi được điều chế và thu bằng cách nào? Viết phương trình hóa học minh họa.
Câu 2: (1,5 điểm)
Hoàn thành các phương trình hóa học sau: (ghi rõ điều kiện của phản ứng)
- CuO + .............
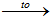 Cu + H2O
Cu + H2O - ............... + H2O → H2SO4
- K2O + .............. → 2KOH
- 2H2O
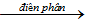 ............. + O2
............. + O2 - 2H2 + ...............
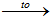 2H2O
2H2O - 2Na + 2H2O → .............. + H2
Câu 3: (2 điểm)
a. Hoà tan 10 gam đường vào 40 gam nước. Tính nồng độ phần trăm của dung dịch.
b. Trong 200 ml dung dịch có hoà tan 20 gam NaOH. Tính nồng độ mol của dung dịch.
Câu 4: (3 điểm)
Cho 5,4 gam nhôm phản ứng hoàn toàn với dung dịch axit clohiđric. Phản ứng xảy ra theo sơ đồ sau:
Al + HCl → AlCl3 + H2
- Lập phương trình hóa học
- Tính thể tích khí hiđro thu được ở đktc.
- Tính khối lượng muối AlCl3 tạo thành.
Câu 5: (1 điểm)
Giải thích vì sao sự cháy trong không khí xảy ra chậm hơn và tạo ra nhiệt độ thấp hơn so với sự cháy trong khí oxi?
(Cho: H = 1; Cl= 35,5; O = 16; Al= 27; Na=23)
ĐÁP ÁN VÀ BIỂU ĐIỂM
|
Câu |
Đáp án |
Biểu điểm |
|
1 |
a. *Tính chất vật lí của oxi: - Oxi là chất khí không màu, không mùi, ít tan trong nước, nặng hơn không khí - Hóa lỏng ở - 1830C, oxi lỏng có màu xanh nhạt * Tính chất hóa học của oxi: - Tác dụng với phi kim - Tác dụng với kim loại - Tác dụng với hợp chất b. - Trong phòng thí nghiệm khí oxi được điều chế bằng cách đun nóng những hợp chất giàu oxi và dễ bị nhiệt phân hủy ở nhiệt độ cao. - Cách thu: đẩy không khí và đẩy nước. - PTHH: 2KMnO4 ( Hs có thể viết PTHH khác) |
0,25 điểm
0,25 điểm
0,25 điểm 0,25 điểm 0,25 điểm
0,5 điểm
0,25 điểm 0,5 điểm |
|
2 |
a. CuO + H2 b. SO3 + H2O → H2SO4 c. K2O + H2O → 2KOH d. 2H2O e. 2H2 + O2 f. 2Na + 2H2O → 2NaOH + H2 |
0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm |
|
3 |
a. Khối lượng dung dịch đường: 10 + 40 = 50 (g) Nồng độ phần trăm của dung dịch đường: C%đường = 10 x 100% : 50 = 20% b. - Số mol NaOH: 20 : 40 = 0,5 (mol) - Nồng độ mol của dung dịch NaOH : CM = 0,5/0,2= 2,5M |
0,5 điểm
0,5 điểm
0,5 điểm
0,5 điểm |
|
4 |
a. Phương trình hóa học: 2Al + 6HCl → 2AlCl3 + 3H2 2 mol 2 mol 3 mol 0,2 mol 0,2 mol 0,3 mol Số mol của nhôm là: nAl = m : M = 5,4 : 27 = 0,2 mol b. Thể tích khí hiđro là: VH2 = n.22,4 = 0,3.22,4 = 6,72 (lít) c. Khối lượng nhôm clorua tạo thành là: mnhôm clorua = n.M = 0,2.133,5 = 26,7(gam) |
0,5 điểm
1 điểm
0,5 điểm
0,5 điểm
0,5 điểm |
|
5 |
Sự cháy trong không khí xảy ra chậm hơn và tạo ra nhiệt độ thấp hơn so với sự cháy trong khí oxi vì: - Trong không khí thể tích khí nitơ gấp 4 lần thể tích khí oxi nên diện tích tiếp xúc của chất cháy với các phân tử oxi ít hơn nhiều lần nên sự cháy diễn ra chậm hơn. - Một phần nhiệt tiêu hao để đốt nóng khí nitơ nên nhiệt độ đạt được thấp hơn. |
0,5 điểm
0,5 điểm |
