Đề thi Học kì 2 Hóa 10 có đáp án - Đề 8
Đề thi Học kì 2 Hóa 10 có đáp án- Đề 8
ĐỀ BÀI
Cho biết nguyên tử khối (theo đvC) của một số nguyên tố: H = 1; C = 12; N = 14; O = 16; Mg = 24; P = 31; S = 32; Cl = 35,5; K = 39; Ca = 40; Mn = 55; Fe = 56; Cu = 64; Zn = 65;
Br = 80; Ag = 108; I = 127; Ba = 137.
Câu 1: Khí clo có màu
A. trắng B. vàng lục C. nâu D. không màu
Câu 2: Chất nào tồn tại dạng lỏng ở điều kiện thường ?
A. Flo B. Brom C. Clo D. Iot
Câu 3: Hai dạng thù hình quan trọng của oxi là
A. O2 và H2O2 B. O2 và SO2 C. O2 và O3 D. O3 và O2-
Câu 4: Các nguyên tố thuộc nhóm VIA là
A. S, O, Se, Te B. S, O, Cl, Se C. F, O, Se, Te D. F, Cl, S, O
Câu 5: Hỗn hợp nào sau đây là nước Gia-ven ?
A. NaClO, NaCl, H2O B. NaClO, HClO, H2O
C. NaClO, H2O D. NaCl, HClO4, H2O
Câu 6: Khoảng 90% lưu huỳnh được sử dụng để
A. Làm thuốc nổ, nhiên liệu tên lửa.
B. Sản xuất thuốc trừ sâu, chất diệt nấm mốc.
C. Vật liệu y
D. Sản xuất axit
Câu 7: Công thức hóa học của clorua vôi là
A. Ca(OH)2 B. CaCl2 C. CaOCl2 D. CaO
Câu 8: Phản ứng hóa học nào sau đây dùng để sản xuất khí clo trong công nghiệp ?
A. MnO2 + 4HCl ® MnCl2 + Cl2 + 2H2O
B. KClO3 + 6HCl → KCl + 3H2O + 3Cl2↑
C. 2NaCl → 2Na + Cl2
D. 2NaCl + 2H2O → H2 + Cl2 + 2NaOH
Câu 9: Trong một phân tử lưu huỳnh có bao nhiêu nguyên tử lưu huỳnh ?
A. 8 B. 6 C. 2 D. 1
Câu 10: Số oxi hóa của lưu huỳnh trong hợp chất SF6 là
A. –2 B. –1 C. +4 D. +6
Câu 11: Cần bao nhiêu thể tích dung dịch HCl 1,2M để trung hòa hoàn toàn 50 ml dung dịch NaOH 3M ?
A. 130 ml B. 125 ml C. 100 ml D. 75 ml
Câu 12: X là chất khí không màu, mùi hắc, rất độc, tan nhiều trong nước tạo ra dung dịch axit yếu. X là
A. H2S B. SO2 C. HCl D. SO3
Câu 13: Phản ứng hóa học nào sau đây chứng tỏ SO2 có tính khử ?
A. SO2 + 2H2S → 3S + 2H2O B. SO2 + 2Mg → S + 2MgO
C. SO2 + Br2 + 2H2O → 2HBr + H2SO4 D. SO2 + H2O → H2SO3
Câu 14: Hỗn hợp khí nào dưới đây có thể gây nổ khi trộn đúng tỉ lệ và điều kiện thích hợp ?
A. SO2 và O2 B. Cl2 và O2 C. H2 và Cl2 D. H2S và O2
Câu 15: Có thể dùng chất nào để phân biệt hai dung dịch không màu Na2SO4 và H2SO4 ?
A. Dung dịch BaCl2 B. Dung dịch Ba(OH)2 C. Phenolphtalein D. Fe
Câu 16: Điều nào sau đây không đúng khi nói về khí clo ?
A. Là chất oxi hóa mạnh. B. Nặng hơn không khí và rất độc.
C. Cl2 oxi hóa Fe lên Fe3+. D. Khí clo ẩm làm quỳ tím hóa đỏ.
Câu 17: Chất nào sau đây có độ âm điện lớn nhất ?
A. O B. S C. F D. Cl
Câu 18: Trong công nghiệp, lưu huỳnh trioxit được sản xuất bằng cách nào ?
A. Cho lưu huỳnh tác dụng với axit sunfuric đậm đặc, đun nóng.
B. Oxi hóa lưu huỳnh đioxit ở nhiệt độ cao, có xúc tác V2O5.
C. Đốt quặng pirit sắt.
D. Cho lưu huỳnh tác dụng với axit nitric đậm đặc, đun nóng.
Câu 19: Cho sơ đồ thí nghiệm điều chế chất X trong phòng thí nghiệm như hình vẽ dưới đây. X và Y lần lượt là
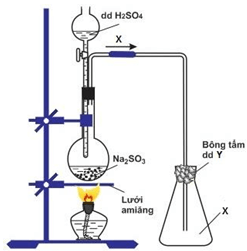
A. H2S và NaOH B. SO2 và NaOH C. SO2 và NaCl D. H2S và NaCl
Câu 20: Ứng dụng quan trọng của ozon là
A. Làm thuốc chống sâu răng.
B. Chất tẩy trắng bột giấy, quần áo, chất sát trùng trong y tế.
C. Làm chất oxi hóa cho nhiên liệu lỏng dùng trong tên lửa.
D. Khử trùng nước, khử mùi, bảo quản hoa quả.
Câu 21: Trong các axit dưới đây, axit nào mạnh nhất ?
A. HClO B. HClO2 C. HClO3 D. HClO4
Câu 22: Đâu không phải là điểm giống nhau giữa oxi và lưu huỳnh ?
A. Đều là các phi kim hoạt động mạnh.
B. Đều thuộc nhóm
C. Đều thể hiện tính oxi hóa khi tác dụng với khí H2.
D. Đều có khả năng thể hiện số oxi hóa –2 trong hợp chất.
Câu 23: Một học sinh trong lúc điều chế khí clo ở phòng thí nghiệm đã vô ý làm đứt ống dẫn khí làm khí clo bay ra khắp phòng. Lúc này hóa chất tốt nhất để khử khí clo độc là
A. Khí H2 B. Khí NH3
C. Dung dịch NaOH loãng D. Dung dịch NaCl
Câu 24: Chất nào sau đây vừa có tính oxi hóa, vừa có tính khử ?
A. F2 B. O3 C. H2SO4 D. Cl2
Câu 25: Hoà tan hoàn toàn 29,75 gam KBr vào 50 ml dung dịch AgNO3 4M. Khối lượng kết tủa thu được sau phản ứng là
A. 47 gam B. 28,7 gam C. 37,6 gam D. 35,8 gam
Câu 26: Trong các quặng sau, loại quặng nào chứa hàm lượng lưu huỳnh cao nhất ?
A. Barit (BaSO4) B. Pirit đồng (CuFeS2)
C. Thạch cao (CaSO4.2H2O) D. Pirit sắt (FeS2)
Câu 27: Phát biểu nào sau đây sai ?
A. Khí SO2 có khả năng làm mất màu dung dịch
B. Các kim loại Cu, Fe tác dụng với H2SO4 đặc nóng thì thu được sản phẩm khử là SO2.
C. HCl chỉ thể hiện tính oxi hóa trong các phản ứng hóa học.
D. Trong tự nhiên, các khoáng vật chứa clo là cacnalit và
Câu 28: Phát biểu nào sau đây là đúng ?
A. Tính oxi hóa của lưu huỳnh yếu hơn oxi nhưng tính khử mạnh hơn
B. Hai dạng thù hình của lưu huỳnh là lưu huỳnh đơn tà và lưu huỳnh lập phương.
C. Lưu huỳnh có thể phản ứng với các phi kim (O2, F2, N2, I2) ở nhiệt độ
D. Cấu hình electron của lưu huỳnh là [He]2s22p4.
Câu 29: Cho các phản ứng sau: FeS + H2SO4 → X + Y
Y + O2 (thiếu) → H2O + Z Các chất Y, Z lần lượt là
A. SO2, SO3 B. H2S, S C. S, SO2 D. H2S, SO2
Câu 30: Dãy các chất đều phản ứng với dung dịch H2SO4 loãng là
A. CuS, CuO, Cu(OH)2 B. Cu, CuO, Cu(OH)2
C. CaS, CaO, CaCl2 D. CaS, CaCO3, Ca(NO3)2
Câu 31: Muối ăn có lẫn bột lưu huỳnh. Có thể làm sạch muối ăn bằng phương pháp nào sau đây ?
A. Đốt cháy hỗn hợp, lưu huỳnh sẽ phản ứng với khí O2 tạo khí SO2 bay đi, còn lại muối ăn.
B. Dẫn khí H2 qua hỗn hợp muối ăn và lưu huỳnh đun nóng. Khí H2 phản ứng với lưu huỳnh tạo khí H2S bay đi, còn lại muối ăn.
C. Hòa tan hỗn hợp vào nước, sau đó cho hỗn hợp hòa tan vào phễu có đặt sẵn giấy lọc, bột lưu huỳnh sẽ bị giữ lại, cô cạn dung dịch nước muối thu được muối ăn.
D. Hòa tan hỗn hợp vào dung dịch H2SO4 đặc, NaCl sẽ phản ứng với axit tạo khí HCl, dẫn khí HCl sinh ra vào dung dịch NaOH sẽ thu được dung dịch NaCl, cô cạn dung dịch thu được muối ăn.
Câu 32: Khí oxi không thể phản ứng trực tiếp với chất nào sau đây ?
A. H2 B. CH4 C. Fe D. Cl2
Câu 33: Hợp chất nào sau đây chứa liên kết ion ?
A. NaCl B. HCl C. H2S D. SO2
Câu 34: Hòa tan hoàn toàn 11,7 gam kim loại M (hóa trị II) vào dung dịch H2SO4 loãng thì thu được 4,032 lít khí (ở đktc). Kim loại M là
A. Fe B. Cu C. Mg D. Zn
Câu 35: Phản ứng hóa học nào sau đây không chính xác ?
A. Br2 + 2NaCl → 2NaBr + Cl2
B. Cu + Cl2 → CuCl2
C. Cl2 + 2NaI → 2NaCl + I2
D. Fe + 2HBr → FeBr2 + H2
Câu 36: Những chất nào sau đây có thể cùng tồn tại trong một dung dịch ?
A. KCl, AgNO3, HNO3, NaNO3 B. K2SO3, KCl, HCl, NaCl
C. NaF, AgNO3, CaF2, NaNO3 D. H2SO4, HCl, Ba(NO3)2, NaF
Câu 37: So sánh khả năng phản ứng dễ dàng với nước của các halogen. Kết luận nào sau đây là đúng ?
A. F2 > Cl2 > Br2 > I2 B. I2 > Br2 > Cl2 > F2
C. F2 > Br2 > Cl2 > I2 D. I2 > Cl2 > Br2 > F2
Câu 38: Để điều chế một lượng khí O2, người ta nhiệt phân 79 gam KMnO4. Sau một thời gian phản ứng, lấy toàn bộ chất rắn thu được sau phản ứng đem cân thì thấy khối lượng giảm 8,91% so với ban đầu. Thể tích khí O2 (ở đktc) đã điều chế được là ?
A. 4,928 lít B. 4,480 lít C. 5,600 lít D. 5,105 lít
Câu 39: Vì sao cấu tạo phân tử H2S có hình dạng gấp khúc ?
A. Do tương tác đẩy của hai cặp electron chưa liên kết trong nguyên tử lưu huỳnh.
B. Độ âm điện của lưu huỳnh cao hơn H làm lệch liên kết H –
C. Tương tác hút giữa hai nguyên tử H kéo hai liên kết H – S lại gần
D. Do kích thước của nguyên tử lưu huỳnh lớn hơn nguyên tử hiđro.
Câu 40: Một axit có dạng HnX (với X là các halogen hoặc nhóm nguyên tử), tỉ lệ khối lượng H : X = 2 : 71. Hòa tan hoàn toàn một thanh sắt bằng lượng vừa đủ dung dịch HnX 20% thì thu được dung dịch muối có nồng độ với giá trị gần đúng là
A. 30,17% B. 20,00% C. 31,65% D. 30,31%
-HẾT-
Thí sinh không được sử dụng tài liệu. Giám thị không giải thích gì thêm.
ĐÁP ÁN VÀ BIỂU ĐIỂM
| 1B | 2B | 3C | 4A | 5A | 6D | 7C | 8D | 9A | 10D |
| 11B | 12B | 13C | 14C | 15D | 16D | 17C | 18B | 19B | 20D |
| 21D | 22A | 23B | 24D | 25C | 26D | 27C | 28A | 29B | 30C |
| 31C | 32D | 33A | 34D | 35A | 36C | 37A | 38A | 39A | 40D |
