Đề thi Học kì 2 Hóa 10 có đáp án - Đề 6
Đề thi Học kì 2 Hóa 10 có đáp án- Đề 6
ĐỀ BÀI
I. Trắc nghiệm (3,0 điểm)
Câu 1: Chất nào sau đây có tính tẩy màu?
A. H2S B. Br2 C. SO2 D. O2
Câu 2: Để điều chế hiđro clorua trong phòng thí nghiệm, người ta dùng phản ứng nào sau đây?
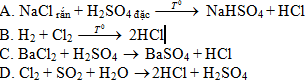
Câu 3: Trong sinh hoạt người ta sử dụng loại hóa chất nào sau đây để làm sạch nước máy, bể bơi?
A. F2 B. Br2 C. O2 D. Cl2
Câu 4: Dãy chất nào sau đây đều tác dụng được với dung dịch H2SO4 loãng?
A. BaCl2, Ba, Cu, CuO C. BaCl2, Fe, CuO, Na2CO3
B. Ag, Fe, Fe2O3, FeCO3 D. Fe, FeCO3, Cu, CuSO4
Câu 5: Sục 7,84 lít khí SO2 ở đktc vào 250 ml dung dịch NaOH 2M thu được dung dịch X. Nồng độ mol/l của các chất trong dung dịch X là:
A. 0,6M Na2SO3 và 0,6M NaHSO3 C. 0,8M Na2SO3 và 0,6M NaHSO3
B. 0,6M Na2SO3 và 0,8M NaHSO3 D. 0,6M Na2SO3 và 0,8M NaOH
Câu 6: Lấy 20 ml dung dịch HCl 2M vào một ống nghiệm rồi thả vào đó một mẩu quỳ tím. Nhỏ từ từ dung dịch KOH 1M vào ống nghiệm trên đến khi thấy màu giấy quỳ thành màu tím trở lại thì hết đúng V ml. Giá trị của V là:
A. 0 ml B. 40 ml C. 20 ml D. 80 ml
II–Tự luận (7,0 điểm)
Bài 1. (2,5 điểm)
Hoàn thành các phương trình hóa học sau (ghi rõ điều kiện phản ứng nếu có).
A. Al + Cl2 →
B. Dd AgNO3 + dd KBr →
C. H2S + O2 dư →
D. Cl2 + dd NaI →
E. FeCO3 + H2SO4 đặc, nóng →
Bài 2. (1,5 điểm)
Bằng phương pháp hóa học, hãy phân biệt các dung dịch mất nhãn đựng trong các ống nghiệm riêng biệt sau (viết các phương trình hóa học xảy ra nếu có): KOH; Na2S; K2SO4; MgCl2
Bài 3. (3,0 điểm)
Hòa tan 22,8 gam hỗn hợp A gồm Mg và Fe vào dung dịch H2SO4 80% (đặc, nóng, vừa đủ). Sau khi phản ứng xảy ra hoàn toàn, thấy thoát ra 15,68 lít khí SO2 là sản phẩm khử duy nhất (ở đktc) và dung dịch B.
a. Tính thành phần % khối lượng mỗi kim loại trong A. (1,5điểm)
b. Tính C% mỗi chất trong dung dịch B. (1điểm)
c. Oxi hóa 11,4 gam hỗn hợp A bằng 4,48 lít hỗn hợp khí X gồm oxi và clo có tỉ khối hơi so với H2 là 25,75. Sau phản ứng hoàn toàn thu được m gam hỗn hợp rắn Y. Cho Y tác dụng với lượng dư dung dịch H2SO4 đặc nóng thu được V lít SO2 (đktc). Tính V? (0,5 điểm)
(Cho: Fe =56; Mg=24; O=16; H =1; Cl =35,5; Na=23; O=16; S=32; Cl=35,5)
(Học sinh không được sử dụng Bảng tuần hoàn)
ĐÁP ÁN VÀ BIỂU ĐIỂM
I. Trắc nghiệm (3,0 điểm)
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
|
Đáp án |
C |
A |
D |
C |
B |
B |
II. Tự luận (7,0 điểm)
Bài 1: (2,5 điểm). Mỗi phương trình đúng được 0,5 điểm.Thiếu cân bằng và điều kiện phản ứng trừ 0,25 điểm.
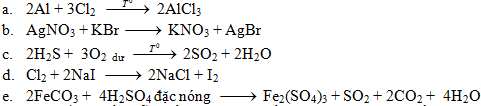
Bài 2: (1,5 điểm). Lấy mỗi chất một ít ra các ống nghiệm riêng biệt rồi đánh số từ 1-4
|
|
KOH |
Na2S |
K2SO4 |
MgCl2 |
|
Quỳ tím |
Xanh |
- |
- |
- |
|
Dd BaCl2 |
X |
- |
trắng |
- |
|
Dd AgNO3 |
X |
đen |
X |
trắng |
PTHH
BaCl2 + K2SO4 → BaSO4 + 2KCl
2AgNO3+ Na2S → Ag2S + 2NaNO3
2AgNO3+ MgCl2 → 2AgCl + Mg(NO3)2
Các phương pháp nhận biết khác nếu đúng vẫn được điểm tối đa.
Bài 3: (3,0 điểm)
|
a. (1,5 đ) Mg +2H2SO4 đặc nóng → MgSO4 +SO2 + 2H2O x 2x x x (mol) 2Fe +6H2SO4 đặc nóng → Fe2(SO4)3 +3SO2 + 2H2O y 3y y/2 1,5y (mol)
|
0,5đ
|
|
Gọi số mol Mg và Fe lần lượt là x và y (mol) → mA = 24x + 56y = 22,8 (g) (1) nSO2 = 0,7 (mol) => x + 1,5y = 0,7 mol (2) Giải hệ pt (1) và (2) → x = 0,25; y = 0,3 (mol) %mMg = 26,32%; %mFe = 73,68% |
1đ |
|
b. (1,0 đ) mddB = 22,8 + 1,4.98.100/80 – 0,7.64 = 149,5 g C% MgSO4 = 20,066 %; C% Fe2(SO4)3 = 40,133 % |
1đ |
|
c. (0,5 đ) Bản chất của 2 quá trình xảy ra như sau: Fe0 → Fe+3 +3e O2 + 4e → 2O-2 0,15 0,45 0,1 0,4 Mg0→ Mg+2 +2e Cl2 + 2e → 2Cl- 0,125 0,25 0,1 0,2 S+6 + 2e → S+4 a 2a a Theo định luật bảo toàn e ta có PT: 0,45 + 0,25 = 0,4 +0,2 + 2a ↔ a = 0,05 Số mol của SO2 = 0,05 mol Thể tích của SO2 = 0,05. 22,4= 1,12 lít. |
0,5đ |
