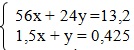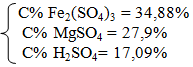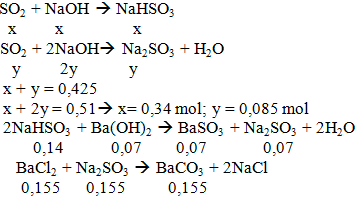Đề thi Học kì 2 Hóa 10 có đáp án - Đề 3
Đề thi Học kì 2 Hóa 10 có đáp án - Đề 3
ĐỀ BÀI
I. Trắc nghiệm (3,0 điểm)
Câu 1. Trong các phản ứng sau, phản ứng nào dùng để điều chế SO2 trong phòng thí nghiệm?
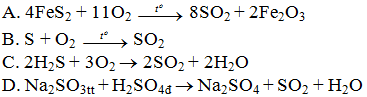
Câu 2. Cho các chất: Cu, NaOH, K2S, MgCl2, Mg lần lượt vào dung dịch H2SO4 loãng. Số phương trình phản ứng xảy ra là:
A. 2
B. 3
C. 4
D. 5
Câu 3. Cho các khí sau Cl2, HCl, O2, H2S. Khí có độ tan trong H2O nhiều nhất:
A. Cl2
B. HCl
C. O2
D. H2S
Câu 4. Cho sơ đồ phản ứng sau: Al + H2SO4 → Al2(SO4)3 + H2S + H2O
Tổng hệ số tối giản của các chất tham gia phản ứng là:
A. 18
B. 30
C. 23
D. 45
Câu 5. Cho 29,75 gam muối KX (X là nguyên tố halogen) tác dụng với dung dịch AgNO3 dư thu được 47 gam kết tủa. X là:
A. Flo
B. Clo
C. Brom
D. Iot
Câu 6. Sục 4,48 lít khí (đktc) vào 250 ml dd NaOH 1M thu được dd X. Dung dịch X gồm các chất tan là:
A. NaHSO3; Na2SO3
B. NaOH; Na2SO3
C. NaHSO3; Na2SO3; NaOH
D. NaOH; NaHSO3
II. Tự luận (7 điểm)
Câu 1: (2 điểm). Hoàn thành các phương trình hóa học của các phản ứng sau (ghi rõ điều kiện nếu có).
A. Fe + Cl2 →
B. Al + H2SO4 loãng →
C. H2S + O2 dư →
D. FeS + H2SO4 đặc →
Câu 2: (2 điểm).
Bằng phương pháp hóa học, nhận biết các dung dịch mất nhãn đựng riêng biệt sau (viết các phương trình hóa học xảy ra): KCl, Na2S, H2SO4, MgSO4.
Câu 3: (3 điểm). Hòa tan hoàn toàn 13,2 gam hỗn hợp A gồm Fe và Mg bằng 100 gam dd H2SO4 98% dư thu được dd B và 9,52 lít khí SO2 (Đktc).
a. Tính % khối lượng mỗi chất trong hỗn hợp A.
b. Tính C% các chất trong dd B.
c.Dẫn toàn bộ lượng SO2 thu được ở trên vào 119 gam NaOH 20% thu được dung dịch D. Thêm vào dung dịch D, 200 ml dung dịch chứa Ba(OH)2 0,35M và BaCl2 1M thu được m gam kết tủa. Tính m.
(Cho H=1, O=16, S=32, F=19, Br=80, Na=23, Cl=35,5, I=127, Fe=56, Mg=24, Ba=137, Ag=108)
----------------- Hết --------------------
Học sinh không được sử bảng tuần hoàn và tài liệu khác.
ĐÁP ÁN VÀ BIỂU ĐIỂM
I. Trắc nghiệm (3 điểm)
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
|
Đáp án |
D |
B |
B |
C |
C |
A |
II – Tự luận (7 điểm)
Câu 1. (2,0đ). Mỗi phương trình đúng được 0,5 điểm. Thiếu cân bằng và điều kiện phản ứng trừ 0,25 điểm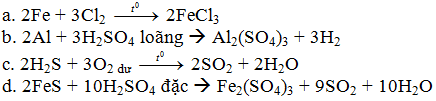
Câu 2. (2,0đ). Nhận biết được mỗi chất được 0,5 điểm.
KCl, Na2S, H2SO4, MgSO4.
Lấy mỗi chất một ít ra các ống nghiệm riêng biệt rồi đánh số từ 1-4.
|
|
KCl |
Na2S |
H2SO4 |
MgSO4 |
|
Quỳ tím |
- |
- |
Đỏ |
- |
|
Dung dịch BaCl2 |
- |
- |
X |
Kết tủa trắng |
|
Dd AgNO3 |
Kết tủa trắng |
Kết tủa đen |
X |
X |
Phương trình phản ứng
BaCl2 + MgSO4 → BaSO4 + MgCl2
AgNO3 + KCl → AgCl + KNO3
2AgNO3 + Na2S → Ag2S + 2NaNO3
Các phương pháp nhận biết khác nếu đúng vẫn được điểm tối đa.
Câu 3.
|
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O x 3x x/2 1,5x Mg + 2H2SO4 → MgSO4 + SO2 + 2H2O y 2y y y |
0,5 đ |
|
nSO2 = 0,425 mol n H2SO4 = 1 mol ta có hệ phương trình: x= 0,15 mol; y=0,2 mol a. %Fe=63,63%; %Mg =36,37% |
1 đ |
|
b. mddB = 13,2 + 100-0,425.64 = 86 gam dung dịch B: Fe2(SO4)3: 0,075 mol; MgSO4: 0,2 mol; H2SO4 dư: 0,15 mol |
1 đ |
|
c. nSO2 = 0,425 mol n NaOH = 0,51 mol n Ba(OH)2 = 0,07 mol n BaCl2 = 0,2 mol T =0,51/0,425 = 1,2 → 2 muối mkết tủa = (0,07+ 0,155).217 = 48,825 gam (Có thể làm theo phương pháp ion) |
0,5 đ |