Đề thi Học kì 2 Hóa 10 có đáp án - Đề 7
Đề thi Học kì 2 Hóa 10 có đáp án- Đề 7
ĐỀ BÀI
I. Phần chung cho các ban : ( 8 điểm )
Câu 1 : ( 2 điểm)
Viết phương trình phản ứng thực hiện dãy chuyển hóa sau ( ghi rõ điều kiện phản ứng ) :
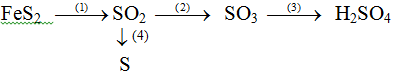
Câu 2 : (2 điểm)
Trình bày phương pháp hóa học phân biệt các dung dịch : NaCl , Na2SO4 , NaNO3 và H2SO4 đựng trong các lọ mất nhãn .
Câu 3 : (2 điểm)
Sắp xếp các chất : Br2 , Cl2 , I2 theo thứ tự tính oxi hóa giảm dần . Viết phương trình phản ứng minh họa và cho biết vai trò các chất tham gia phản ứng
Câu 4 : ( 2 điểm )
Hòa tan hoàn toàn 15,2 gam hỗn hợp gồm Fe và Cu trong dung dịch H2SO4 đặc , nóng , dư thì thu được 6,72 lít khí SO2 (đktc) .
a. Viết các phương trình phản ứng xảy ra .
b. Tính thành phần % về khối lượng của từng kim loại trong hỗn hợp ban đầu .
II. Phần riêng cho các ban : ( 2 điểm )
1. Phần chỉ dành riêng cho chương trình chuẩn ( ban cơ bản và ban C ) :
Câu 5a :
Xét hệ cân bằng sau trong một bình kín :
![]()
Cân bằng trên chuyển dịch như thế nào khi biến đổi một trong các điều kiện sau ? tại sao ?
a. Giảm nhiệt độ .
b. Thêm khí H2 vào .
c. Dùng chất xúc tác .
2. Phần chỉ dành riêng cho chương trình nâng cao ( ban A ) :
Câu 5b :
Cho phản ứng thuận nghịch : ![]()
a. Ở một nhiệt độ nhất định , phản ứng trên đạt đến trạng thái cân bằng khi nồng độ các chất như sau : [N2] = 0,01 M ; [H2] = 2,0 M và [NH3] = 0,4 M . Tính hằng số cân bằng của phản ứng ở nhiệt độ đó .
b. Cân bằng trên chuyển dịch như thế nào khi biến đổi một trong các điều kiện sau ? tại sao ?
- Khi tăng nồng độ H2 .
- Khi giảm áp suất của hệ .
-----------------Hết -----------------
ĐÁP ÁN VÀ BIỂU ĐIỂM
I. Phần chung cho các ban : ( 8 điểm )
Câu 1 : ( 2 điểm) Viết phương trình phản ứng thực hiện dãy chuyển hóa sau ( ghi rõ điều kiện phản ứng ) :
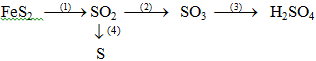
1/ 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 ……………………….0,5 điểm
2/ 2SO2 + O2 → 2SO3 …….............……………………….0,5 điểm
3/ SO3 + 2H2O → H2SO4 …………………......……………….0,5 điểm
4/ 2H2S + SO2 → 3S↓ + 2H2O ……………………….....……..0,5 điểm
Câu 2 : (2 điểm) Trình bày phương pháp hóa học phân biệt các dung dịch : NaCl , Na2SO4 , NaNO3 và H2SO4 đựng trong các lọ mất nhãn .
- Dùng quỳ tím : nhận biết được axit H2SO4 (hóa đỏ) 0,25 điểm
- Dùng BaCl2: nhận biết Na2SO4 (kết tủa trắng) 0,25 điểm
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl 0,5 điểm
- Dùng AgNO3: nhận biết NaCl (kết tủa trắng) 0,25 điểm
NaCl + AgNO3 → AgCl↓ + NaNO3 0,5 điểm
- Mẫu không phản ứng là NaNO3 0,25 điểm
Câu 3 : (2 điểm) Sắp xếp các chất : Br2 , Cl2 , I2 theo thứ tự tính oxi hóa giảm dần . Viết phương trình phản ứng minh họa và cho biết vai trò các chất tham gia phản ứng .
- Thứ tự tính oxi hóa giảm dần : Cl2 > Br2 > I2 …………………………. 0,5 đ
- Phương trình phản ứng : Cl2 + 2 NaBr → NaCl + Br2 …………... 0,5 đ
(C. oh) (C.Khử ) ………………………………. 0,25 đ
Br2 + 2 NaI → NaBr + I2 ……………… 0,5 đ
(C. oh) (C.Khử )……………………………….. 0,5 đ
Lưu ý : Khi xđ vai trò của các chất tham gia : đúng cả 2 chất mới cho điểm : 0,25 đ
Câu 4 : ( 2 điểm ) Hòa tan hoàn toàn 15,2 gam hỗn hợp gồm Fe và Cu trong dung dịch H2SO4 đặc , nóng , dư thì thu được 6,72 lít khí SO2 (đktc) .
a/ Viết các phương trình phản ứng xảy ra .
b/ Tính thành phần % về khối lượng của từng kim loại trong hỗn hợp ban đầu .
Ta có : = 0,3 mol ………………………………………………… 0,25 mol
2Fe + 6 H2SO4 → Fe2(SO4)3 + 3 SO2 + 6 H2O…………..0,25 mol
x
Cu + 2 H2SO4 → CuSO4 + SO2 + 2H2O……………….0,25 mol
y y
3x/2+ y = 0,3 …………………………………………………….0,25 mol
56x + 64 y = 15,2 ………………………………………… …….. 0,25 mol
x = 0,1 ; y = 0,15 …………………………………………0,25 mol
% Fe = 36,8 % …………………………………………………….0,25 mol
% Cu = 63,2 …………………………………………………….0,25 mol
II. Phần riêng cho các ban : ( 2 điểm )
1. Phần chỉ dành riêng cho chương trình chuẩn ( ban cơ bản và ban C ) :
Câu 5a :
Xét hệ cân bằng sau trong một bình kín :
![]()
Cân bằng trên chuyển dịch như thế nào khi biến đổi một trong các điều kiện sau ? tại sao ?
a. Giảm nhiệt độ .
b. Thêm khí H2 vào .
c. Dùng chất xúc tác .
Giải :
a. Giảm nhiệt độ :
- Cân bằng chuyển dịch theo chiều thuận ...............................0,25 điểm
- Vì khi giảm nhiệt độ cân bằng chuyển dịch theo chiều tăng nhiệt ( tỏa nhiệt ) tức chiều thuận ..................................................................................... 0,5 điểm
b. Thêm khí H2 vào :
- Cân bằng chuyển dịch theo chiều nghịch ..............................0,25 điểm .
Vì khi thêm H2 vào thì nồng độ H2 tăng , nên cân bằng chuyển dịch theo chiều làm giảm nồng độ H2 , tức chiều nghịch ............................................... 0,5 điểm .
c. Dùng chất xúc tác :
- Cân bằng không chuyển dịch .................................................0,25 điểm
- Vì xúc tác không ảnh hưởng tới chuyển dịch cân bằng .........0,25 điểm
2. Phần chỉ dành riêng cho chương trình nâng cao ( ban A ) :
Câu 5b :
![]()
a. Tính hằng số cân bằng của phản ứng , nếu ở trạng thái cân bằng nồng độ của NH3 là 0,30 M ; của N2 là 0,05 M và của H2 là 0,10 M .
b. Cân bằng trên chuyển dịch như thế nào khi biến đổi một trong các điều kiện sau ? tại sao ?
- Khi tăng nồng độ H2 .
- Khi giảm áp suất của hệ .
Giải :
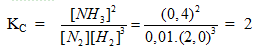
- Viết công thức đúng : 0,5 điểm .
- Đúng đáp án : 0,5 điểm .
b.
- Khi tăng nồng độ H2 cân bằng chuyển dịch theo chiều nghịch ...........................0,25 điểm .
vì cân bằng chuyển dịch theo chiều làm giảm nồng độ khí H2 , tức chiều nghịch ....... 0,25 điểm .
- Khi giảm áp suất của hệ thì cân bằng chuyển dịch theo chiều nghịch ................. ...0,25 điểm
vì cân bằng chuyển dịch theo chiều làm tăng áp suất ( tăng số ptử khí ) , tức chiều nghịch .0,25 điểm
