Đề thi Học kì 2 Hóa 10 có đáp án - Đề 10
Đề thi Học kì 2 Hóa 10 có đáp án - Đề 10
ĐỀ BÀI
(Cho biết khối lượng nguyên tử các nguyên tố: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; S=32; Cl = 35,5; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Br = 80;I=127; Ag = 108; Ba = 137)
Câu 1: Liên kết trong các phân tử đơn chất halogen là gì?
A. Cộng hóa trị không cực. B. Cộng hóa trị có cực.
C. Liên kết ion. D. Liên kết cho nhận.
Câu 2: Chất nào sau đây chỉ có tính oxi hoá, không có tính khử?
A.F2. B. Cl2. C. Br2. D. I2.
Câu 3: Trong những ứng dụng sau, ứng dụng nào không phải của nước Gia-ven?
A. Tẩy uế nhà vệ sinh. B. Tẩy trắng vải sợi.
C. Tiệt trùng nước. D. Tiêu diệt vi khuẩn cúm gà H5N1.
Câu 4: Có 4 dung dịch NaF, NaCl, NaBr, NaI đựng trong các lọ bị mất nhãn. Nếu dùng dung dịch AgNO3 thì có thể nhận được bao nhiêu dung dịch?
A. 4. B. 2. C. 3 D. 1.
Câu 5: Cho a mol chất X tác dụng hết với dung dịch HCl đặc thu được V lít (đktc) khí Cl2. Vậy X là chất nào sau đây để V có giá trị lớn nhất?
A. MnO2. B. KMnO4. C. KClO3. D. CaOCl2.
Câu 6: Đốt cháy 14,875 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 50,375 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng l
A. 8,96 lít. B. 6,72 lít. C. 17,92 lít. D. 11,2 lít.
Câu 7: Kết luận nào sau đây không đúng với flo?
A. F2 là khí có màu lục nhạt, rất độc.
B .F2 có tính oxi hóa mạnh nhất trong tất cả các phi kim
C. F2 oxi hóa được tất cả kim loại.
D. F2 cháy trong hơi H2O tạo HF và O2
Câu 8: Hòa tan hoàn toàn 30,9 gam hỗn hợp gồm Na2CO3 và CaCO3 bằng dung dịch HCl dư, thu được V lít khí CO2 (đktc) và dung dịch chứa 34,2 gam hỗn hợp muối clorua. Giá trị của V là
A.3,36. B. 6,72. C. 2,685. D. 8,4.
Câu 9: Cho 26,25 gam hỗn hợp bột kim loại Zn và Cu vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được 7,84 lít khí H2 và m gam chất rắn không tan. Giá trị của m là:
A. 11,2. B. 14,875. C. 3,85. D. 3,5.
Câu 10: Kim loại nào dưới đây tác dụng với dung dịch HCl loãng và tác dụng với khí Clo cho cùng loại muối Clorua kim loại?
A. Fe. B. Zn. C. Cu. D. Ag.
Câu 11: Phản ứng nào sau đây không đúng?
A. FeO + 2HCl → FeCl2 + H2O. B. 2Fe + 6HCl → FeCl3 + 3H2.
C. Fe2O3 + 6HCl → 2FeCl3+ 3H2O. D. Fe(OH)3 + 3HCl → FeCl3 + 3H2O.
Câu 12: Có các dung môi: nước, benzen, etanol, cacbon tetraclorua. Khí clo tan ít nhất trong dung môi nào?
A. Nước. B. Benzen. C. Etanol. D. Cacbon tetraclorua.
Câu 13: Cấu hình electron lớp ngoài cùng của các nguyên tử các nguyên tố nhóm VIA là:
A. ns2np4. B. ns2np5. C. ns2np3. D. ns2np6.
Câu 14: Trong hợp chất nào sau đây, nguyên tố lưu huỳnh có số oxi hóa lớn nhất?
A. H2S. B. SO2. C. Na2SO3. D. K2SO4.
Câu 15: Trong những câu sau, câu nào sai khi nói về tính chất hóa học của ozon?
A. Ozon oxi hóa tất cả các kim loại. B. Ozon oxi hóa Ag thành Ag2O.
B. Ozon kém bền hơn oxi. D. Ozon oxi hóa ion I- thành I2.
Câu 16: Cho phản ứng hoá học: H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl. Vai trò của H2S trong phản ứng
A. Chất khử. B. Môi trường.
C. Chất oxi hóa. D. Vừa oxi hóa, vừa khử.
Câu 17: Mùa hè thời tiết nóng nực, người ta thường đi du lịch và đặc biệt là những nơi có rừng thông, ở đây thường không khí sẽ trong lành và mát mẻ hơn. Chất nào sau đây làm ảnh hưởng đến không khí trên:
A. Oxi. B. Ozon. C. Hidrosunfua. D. Lưu huỳnh đioxit.
Câu 18: Đốt cháy hoàn toàn 4,8 gam lưu huỳnh thành lưu huỳnh dioxit thì cần vừa đủ V lít không khí (đktc), biết trong không khí thì oxi chiếm 20% thể tích. Gía trị của V là:
A. 17,8. B. 18,8. C. 15,8. D. 16,8.
Câu 19: Ứng dụng nào sau đây không phải của lưu huỳnh dioxit?
A. Sản xuất H2SO4 trong công nghiệp. B. Làm chất tẩy trắng giấy và bột giấy.
B. Làm chất chống nấm mốc lương thực. D. Để sát trùng nước sinh hoạt.
Câu 20: Trong phòng thí nghiệm khí oxi có thể được điều chế bằng cách nhiệt phân muối KClO3 có MnO2 làm xúc tác và có thể được thu bằng cách đẩy nước hay đẩy không khí:
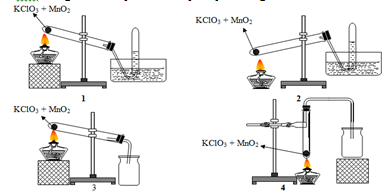
Trong các hình vẽ cho ở trên, hình vẽ mô tả điều chế và thu khí oxi đúng cách là:
A. 1 và 2. B. 2 và 3. C. 1 và 3. D. 3 và 4.
Câu 21: Dẫn 3,36 lít khí H2S (đktc) vào 250 ml dung dịch KOH 2M, sau khi phản ứng hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thu được m gam rắn khan. Gía trị của m là:
A. 16,5 gam B. 27,5 gam C. 14,6 gam D. 27,7 gam.
Câu 22: Cho 13 gam hỗn hợp X gồm hai kim loại đồng và nhôm hòa tan trong dung dịch H2SO4 đặc, nguội, lấy dư thu được 3,36 lit khí SO2 ở đktc và dung dịch Y. Thành phần phần trăm khối lượng của nhôm trong hỗn hợp X là:
A. 73,85% B. 37,69% C. 62,31 D. 26,15%
Câu 23: Hoà tan hoàn toàn 11,9 gam hỗn hợp kim loại Al, Zn, Fe bằng dung dịch H2SO4 loãng, thấy thoát ra V lít khí H2 (đkc). Cô cạn dung sau phản ứng thu được 50,3 muối sunfat khan. Giá trị của V là:
A. 3,36 lít. B. 5,6 lít. C. 6,72 lít. D. 8,96 lít.
Câu 24: Người ta sản xuất axit H2SO4 từ quặng pirit. Nếu dùng 300 tấn quặng pirit có 20% tạp chất thì sản xuất được bao nhiêu tấn dung dịch H2SO4 98%. Biết rằng hao hụt trong sản xuất là 10%?
A. 72 tấn. B. 360 tấn. C. 245 tấn. D. 490 tấn.
Câu 25: Để xác định được mức độ phản ứng nhanh hay chậm người ta sử dụng khái niệm nào sau đây?
A. Tốc độ phản ứng. B. Cân bằng hoá học.
B. Phản ứng một chiều. D. Phản ứng thuận nghịch.
Câu 26: Yếu tố nào dưới đây được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được nấu chín để ủ ancol (rượu)?
A. Chất xúc tác. B. áp suất. C. Nồng độ. D. Nhiệt độ.
Câu 27: Cho phương trình hóa học của phản ứng: X + 2Y ® Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là
A. 4,0.10-4 mol/(l.s). B. 7,5.10-4 mol/(l.s). C. 1,0.10-4 mol/(l.s). D. 5,0.10-4 mol/(l.s).
Câu 28: Mối quan hệ giữa tốc độ phản ứng thuận vt và tốc độ phản ứng nghịch vn ở trạng thái cân bằng được biểu diễn như thế nào?
A. vt = 2vn. B. vt = vn ¹ 0. C. 2vt = vn. D. vt =vn = 0.
Câu 29: Cho cân bằng hóa học: H2 (k) + I2 (k) 2HI (k) ; DH > 0. Cân bằng không bị chuyển dịch khi
A. Tăng nồng độ H2. B. Giảm nồng độ HI.
C. Tăng nhiệt độ của hệ. D. Giảm áp suất chung của hệ.
Câu 30: Cho phản ứng : 2SO2 + O2 → 2SO3. Nồng độ ban đầu của SO2 và O2 tương ứng là 4 mol/lít và 2 mol/lít. Khi cân bằng, có 80% SO2 đã phản ứng, khi đó nồng độ của SO2 và O2 lần lượt là :
A. 3,2M và 3,2M. B. 1,6M và 3,2M. C. 0,8M và 0,4M. D. 3,2M và 1,6M.
ĐÁP ÁN VÀ BIỂU ĐIỂM
| 1A | 2A | 3D | 4A | 5C | 6D | 7C | 8B | 9D | 10B |
| 11B | 12A | 13A | 14D | 15A | 16A | 17B | 18D | 19D | 20C |
| 21D | 22D | 23D | 24B | 25A | 26A | 27C | 28B | 29D | 30C |
