Đề kiểm tra 1 tiết Hóa 10 Chương 5 - Đề 10
Đề kiểm tra 1 tiết Hóa 10 Chương 5 - Đề 10
ĐỀ BÀI
Phần 1: Trắc nghiệm (20 câu - 8,0 điểm)
Câu 1: Trong phòng thí nghiệm, khí clo được điều chế bằng cách khử hợp chất nào sau đây?
A. H2SO4.
B. KMnO4.
C. NaCl.
D. HCl.
Câu 2: Đơn chất halogen nào sau đây là chất lỏng ở điều kiện thường?
A. F2.
B. Cl2.
C. Br2.
D. I2.
Câu 3: Chất nào sau đây không có tính khử?
A. F2.
B. I2.
C. Br2.
D. Cl2.
Câu 4: HCl không phản ứng với chất nào sau đây?
A. Fe.
B. NaOH.
C. Cu.
D. CaO.
Câu 5: Công thức hoá học của clorua vôi là
A. CaCl2.
B. Ca(OCl)2.
C. CaOCl2.
D. Ca(OCl3)2.
Câu 6: Trong phòng thí nghiệm, để khử khí Cl2 dư người ta thường ngâm ống nghiệm chứa khí Cl2 vào dung dịch nào sau đây?
A. Ca(OH)2.
B. HCl.
C. Na2SO4.
D. NaNO3.
Câu 7: Sục khí Cl2 qua dung dịch KI dư có sẵn hồ tinh bột thì màu của dung dịch thu được là
A. vàng nhạt.
B. xanh tím.
C. hồng.
D. không màu.
Câu 8: Phản ứng của dung dịch HCl với chất nào sau đây là phản ứng oxi hóa khử?
A. CuO.
B. NaOH.
C. Fe.
Câu 9: Cho các phản ứng sau:
(1) 4HCl + MnO2 ® MnCl2 + Cl2 + 2H2O
(3) 14HCl +K2Cr7O7 ®2KCl +2CrCl3 +3Cl2 +7H2O
(2) 4HCl + Zn ® ZnCl2 + H2
(4) 6HCl + 2Al ® 2AlCl3 + 3H2
Số phản ứng trong đó HCl thể hiện tính khử là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 10: Để tinh chế NaCl có lẫn NaBr và NaI có thể dùng
A. Cl2.
B. Br2.
C. I2.
D. AgNO3.
Câu 11: Trong điều kiện thích hợp phản ứng giữa cặp chất nào sau đây không xảy ra?
A. H2O và F2.
B. KBr và Cl2.
C. NaI và Br2.
D. KBr và I2.
Câu 12: Cho hình vẽ mô tả quá trình điều chế khí Cl2 trong phòng thí nghiệm như sau:
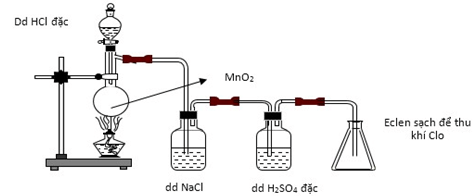
(A) (B)
Khí Cl2 sinh ra thường lẫn khí HCl và hơi nước. Để thu được Cl2 khô thì bình A và B lần lượt chứa các dung dịch nào sau đây?
A. NaOH, H2SO4 đặc.
B. H2SO4 đặc, NaOH.
C. NaCl, NaOH.
D. NaCl, H2SO4 đặc.
Câu 13: Phương trình hóa học nào sau đây đúng?
A. Fe + Cl2 → FeCl2.
B. HF + AgNO3 → AgF + HNO3.
C. 2HCl + Fe → FeCl2 + H2.
D. 2NaCl + I2 → Cl2 + 2NaI.
Câu 14: Phát biểu nào sau đây không đúng?
A. Sục khí Cl2 qua dung dịch KI, dung dịch từ không màu chuyển sang màu xanh tím.
B. F2 oxi hóa được tất cả các kim loại kể cả Au và Pt, oxi hóa hầu hết các phi kim trừ oxi và nitơ.
C. Trong phản ứng với nước, Br2 thể hiện đồng thời tính oxi hóa và tính khử.
D. Phản ứng hóa học của I2 với kim loại xảy ra ở nhiệt độ cao và có chất xúc tác.
Câu 15: Cho 0,012 mol Fe và 0,02 mol Cl2 tham gia phản ứng hoàn toàn với nhau. Khối lượng muối thu được là
A. 2,17 gam.
B. 1,95 gam.
C. 4,34 gam.
D. 3,90 gam.
Câu 16: Cho 1,53 gam hỗn hợp gồm Mg, Fe, Zn vào dung dịch HCl dư thấy thoát ra 448 ml khí (đktc). Cô cạn hỗn hợp sau phản ứng thu được chất rắn có khối lượng là
A. 2,95 gam.
B. 3,9 gam.
C. 2,24 gam.
D. 1,85 gam.
Câu 17: Cho 10,5 gam NaI vào 50 ml dung dịch nước Brom 0,5 M. Khối lượng NaBr thu được là
A. 3,45 gam.
B. 4,67 gam.
C. 5,15 gam.
D. 8,75 gam.
Câu 18: Cho 31,84 gam hỗn hợp NaX và NaY (X, Y là hai halogen ở hai chu kì liên tiếp) vào dung dịch AgNO3 dư thì thu được 57,34 gam kết tủa. Công thức hai muối là
A. NaF và NaCl.
B. NaCl và NaBr.
C. NaBr và NaI.
D. NaI và NaF.
Câu 19: Để nhận biết các dung dịch riêng biệt mất nhãn Na2CO3, NaBr, Na2SO4 và BaCl2 có thể dùng dung dịch thuốc thử nào sau đây?
A. I2.
B. BaCl2.
C. AgNO3.
D. HCl.
Câu 20: Có 4 lọ mất nhãn X, Y, Z, T, mỗi lọ chứa một trong các dung dịch sau: KI, HI, AgNO3, Na2CO3. Biết rằng:
- Nếu cho X phản ứng với các chất còn lại thì thu được một kết tủa.
- Y tạo được kết tủa với cả 3 chất còn lại.
- Z tạo được một kết tủa trắng và 1 chất khí với các chất còn lại.
- T tạo được một chất khí và một kết tủa vàng với các chất còn lại.
Các chất X, Y, Z, T lần lượt là:
A. KI, Na2CO3, HI, AgNO3.
B. KI, AgNO3, Na2CO3, HI.
C. HI, AgNO3, Na2CO3, KI.
D. HI, Na2CO3, KI, AgNO3.
Phần 2: Tự luận (2 câu - 2,0 điểm)
Câu 1: Viết PTHH hoàn thành chuỗi chuyển hóa sau, mỗi mũi tên ứng với một PTHH.
MnO2 " Cl2 " HCl " FeCl2 " Fe(OH)2
Câu 2: Hòa tan hoàn toàn 1,94 gam hỗn hợp X gồm Zn, Mg, Al trong dung dịch HCl vừa đủ thì thấy khối lượng dung dịch tăng thêm 1,79 gam. Cho dung dịch sau phản ứng tác dụng với dung dịch AgNO3 dư thu được m gam kết tủa. Xác dịnh giá trị m.
ĐÁP ÁN
Phần 1: Trắc nghiệm (20x0,4 = 8,0 điểm)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
B |
C |
A |
C |
C |
A |
B |
C |
B |
A |
D |
D |
C |
A |
B |
A |
C |
C |
D |
B |
Phần 2: Tự luận (2x1,0 = 2,0 điểm)
|
Câu |
Đáp án |
Điểm |
|
1 |
Viết đúng PTHH |
4x0,25 = 1,0 điểm |
|
2 |
Tính được mH2 và nH2 = 0,075 mol |
0,5 điểm |
|
Tính được nCl- = 2nH2 = 0,15 mol Tính được nAgCl = nCl- = 0,15 mol → m AgCl = 0,15. 143,5 = 21,525 gam |
0,5 điểm |
