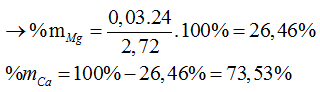Đề kiểm tra 1 tiết Hóa 10 Chương 2 - Đề 10
Đề kiểm tra 1 tiết Hóa 10 Chương 2 - Đề 10
ĐỀ BÀI
Phần 1: Trắc nghiệm (20 câu - 8,0 điểm)
Câu 1: Số nguyên tố thuộc chu kì 3 của bảng tuần hoàn là
A. 2.
B. 8.
C. 18.
D. 32.
Câu 2: Electron hóa trị của các nguyên tố nhóm IA, IIA là các electron
A. s.
B. p.
C. d.
D. f.
Câu 3: Các yếu tố nào sau đây không biến đổi tuần hoàn theo chiều tăng dần điện tích hạt nhân?
A. Bán kính nguyên tử, độ âm điện.
B. Số electron trong nguyên tử, số lớp electron.
C. Tính kim loại, tính phi kim của các nguyên tố.
D. Thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố.
Câu 4: Nguyên tử X có cấu hình electron lớp ngoài cùng là 3s1. Để đạt được cấu hình electron bền vững của khí hiếm gần kề, trong các phản ứng hóa học, X
A. mất 2 electron.
B. mất 1 electron.
C. nhận 2 electron.
D. nhận 1 electron.
Câu 5: Dãy phân tử nào cho dưới đây đều có liên kết cộng hóa trị không phân cực?
A. N2, I2, Cl2, H2.
B. Cl2, CO2, H2S, F2.
C. N2, CH4, H2, HCl.
D. PH3, HF, Cl2, CH4.
Câu 6: Điện hóa trị của F trong hợp chất BaF2 là
A. 2-.
B. -1.
C. 1+.
D. 1-.
Câu 7: Phát biểu nào sau đây không đúng về bảng tuần hoàn các nguyên tố hóa học?
A. Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
B. Các nguyên tố trong cùng nhóm A thì có cùng số electron lớp ngoài cùng trong nguyên tử.
C. Số thứ tự của ô nguyên tố bằng số hiệu nguyên tử của nguyên tố đó.
D. Số thự tự của chu kì bằng số phân lớp electron trong nguyên tử
Câu 8: Nguyên tố R thuộc chu kì 3, nhóm VA. R có cấu hình electron phân lớp ngoài cùng là
A. 2s2.
B. 3s2.
C. 3p3.
D. 2p3.
Câu 9: Cho các phát biểu sau:
1. Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo chiều tăng dần của khối lượng nguyên tử.
2. Chu kì 5 có 18 nguyên tố.
3. Các phân lớp electron trong nguyên tử khí hiếm ở trạng thái cơ bản đều bão hòa.
4. Tính kim loại là tính chất của nguyên tố mà nguyên tử của nó dễ nhận electron để trở thành ion âm. Số phát biểu không đúng là
A.1
B.2.
C.3.
D.4.
Câu 10: Nguyên tố X có số hiệu nguyên tử bằng 15. Hóa trị cao nhất của X với oxi là
A. 3.
B. 5.
C. 7.
D. 6.
Câu 11: Hợp chất nào sau đây là hợp chất ion?
A. K2O.
B. SiH4.
C. Cl2O.
D. CO2.
Câu 12: Cho chất sau: I2 (1), NF3 (2), CaCl2 (3), CCl4 (4), MgO (5). Dãy gồm các chất chỉ có liên kết cộng hóa trị là
A. (1), (2), (5).
B. (1), (2), (4).
C. (1), (3), (5).
D. (2), (4), (5).
Câu 13: Số oxi hóa của Mn trong KMnO4, Zn trong Zn2+, O trong Cl2O, P trong HPO42- lần lượt là:
A. +7, +2, +2, +5.
B. +6, +2, +2, +3.
C. +7, +2, -2, +5.
D. +7, 0, -2, +5.
Câu 14: Cho các nguyên tố: M (Z = 20), X (Z = 12), Y (Z = 14). Phát biểu nào sau đây đúng?
A. M, X, Y đều thuộc chu kì nhỏ trong bảng tuần hoàn.
B. Tính phi kim: Y > X > M.
C. Công thức hợp chất khí của Y với hiđro là H2Y.
D. M, X, Y đều là các nguyên tố kim loại.
Câu 15: Cho các phát biểu sau:
1. Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
2. Các hợp chất cộng hóa trị không tồn tại ở thể rắn.
3. SO24 là ion đơn nguyên tử.
4. Liên kết hóa học được tạo thành giữa nguyên tử kim loại và nguyên tử phi kim luôn là liên kết ion.
Số phát biểu không đúng là
A. 1
B. 2.
C. 3.
D. 4.
Câu 16: Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì có tổng số proton là 27. Vị trí của X và Y trong bảng tuần hoàn là
A. X và Y đều thuộc chu kì 4, X thuộc nhóm IIIA, Y thuộc nhóm IVA.
B. X và Y đều thuộc chu kì 3, X thuộc nhóm IA, Y thuộc nhóm IIA.
C. X và Y đều thuộc chu kì 3, X thuộc nhóm IIIA, Y thuộc nhóm IVA.
D. X và Y đều thuộc chu kì 4, X thuộc nhóm IA, Y thuộc nhóm IIA.
Câu 17: Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4. Trong hợp chất khí của X với hiđro, X chiếm 94,118% khối lượng. Phần trăm khối lượng của X trong oxit cao nhất là
A. 40%.
B. 50%.
C. 60%.
D. 80%.
Câu 18: Số hiệu nguyên tử của nguyên tố X là 11. Tổng số hạt mang điện trong nguyên tử X nhiều hơn tổng số hạt mang điện trong nguyên tử Y là 6 hạt. Công thức của hợp chất hình thành bởi X và Y và loại liên kết hóa học giữa chúng lần lượt là
A. XY2 với liên kết cộng hóa trị.
B. X2Y với liên kết cộng hóa trị.
C. XY2 với liên kết ion.
D. X2Y với liên kết ion.
Câu 19: Cấu hình electron lớp ngoài cùng của nguyên tử X là 2s²2p2. Phát biểu nào sau đây đúng?
A. Điện tích hạt nhân của X bằng 6+.
B. Phân tử XO2 phân cực bởi vì có chứa liên kết X=O phân cực.
C. Trong XO2, X có hóa trị 4+.
D. X thuộc nhóm IIA trong bảng tuần hoàn.
Câu 20: Nguyên tử của nguyên tố X có tổng số electron trong các phân lớp p là 7. Số hạt mang điện của nguyên tử Y nhiều hơn số hạt mang điện của X là 4 hạt. Phát biểu nào sau đây không đúng?
A. Y là phi kim.
B. Công thức hợp chất của Y với hiđro là H2Y.
C. Y thuộc nhóm VA trong bảng tuần hoàn các nguyên tố hóa học.
D. Y thuộc chu kì 3 trong bảng tuần hoàn các nguyên tố hóa học.
Phần 2: Tự luận (2,0 điểm)
Câu 1: Viết công thức cấu tạo của PF3 và C2H4, cho biết hóa trị của P trong PF3 và C trong C2H4. Cho: P (Z=15),F(Z=9),C(Z=6),H(Z=1).
Câu 2: X, Y là 2 kim loại kế tiếp nhau trong nhóm IIA (MX < MY). Hòa tan hết 2,72 gam hỗn hợp Z gồm và Y bằng dung dịch HCl dư thu được 1,792 lít H2 (đktc). Xác định phần trăm khối lượng của X, Y trong Z. (Nhóm IIA gồm các nguyên tố sau: Be = 9, Mg = 24, Ca = 40, Sr =88, Ba = 137)
ĐÁP ÁN
Phần 1: Trắc nghiệm (20x0,4 = 8,0 điểm)
| 1.B | 2.A | 3.B | 4.B | 5.A | 6.D | 7.D | 8.C | 9.B | 10.B |
| 11.A | 12.B | 13.C | 14.B | 15.C | 16.C | 17.A | 18.D | 19.A | 20.B |
Phần 2: Tự luận (2 X 1 = 2,0 điểm)
Câu 1:
- Viết đúng CTCT (0,5 điểm)
- Xác định đúng hóa trị (0,5 điểm)
Câu 2:
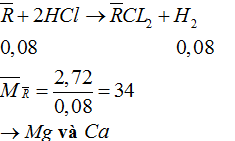
Lập hệ phương trình tính ![]()