Electron độc thân nghĩa là gì? Bài tập xác định electron độc thân
Tổng hợp khái niệm Electron độc thân nghĩa là gì và một số bài tập vận dụng về cách xác định electron độc thân của một số nguyên tử.
1. Electron độc thân nghĩa là gì?
Electron độc thân là electron đứng một mình trong orbital nguyên tử, mà không hình thành cặp electron. Vì electron dạng cặp ổn định hơn, nên electron độc thân tương đối hiếm thấy trong hoá học, và nguyên tử có sẵn các electron độc thân thì dễ tham gia phản ứng. Trong hoá học hữu cơ, electron độc thân thường có ở các gốc tự do, từ đó có thể giải thích nhiều phản ứng hoá học.
Gốc tự do có electron độc thân thường có ở orbital nguyên tử d và f, vì hai loại orbital nguyên tử này ít định hướng, do đó electron độc thân không thể hình thành hiệu quả phân tử dime ổn định.
Electron độc thân cũng hiện diện trong một số phân tử ổn định. Phân tử ôxi có hai electron độc thân, và nitơ oxide (NO) thì có một hạt. Hướng spin của electron độc thân trong phân tử ôxi cố định, do đó nguyên tố ôxi biểu hiện tính thuận từ.
Electron độc thân trong các nguyên tố họ lanthan là electron ổn định nhất, orbital f của chúng phản ứng kém với tác nhân bên ngoài, và electron độc thân khó hình thành liên kết hoá học. Nguyên tử có nhiều electron độc thân nhất là Gd3+, có 7 electron độc thân.
2. Electron hóa trị là gì?
Electron hóa trị (electron ngoài cùng) là những electron ở các orbital ngoài cùng và có thể tham gia vào các liên kết của nguyên tử. Electron hóa trị các nguyên tố nhóm chính nằm ở lớp ngoài cùng, trong nguyên tố nhóm phụ (kim loại chuyển tiếp) electron hóa trị có tại lớp ngoài cùng và lớp d kề cận.
Xem thêm:
>>> Electron hóa trị là gì? Cách xác định electron hóa trị? Cho ví dụ
3. Bài tập xác định electron độc thân
Bài 1: Nguyên tử của nguyên tố phosphorus (Z = 15) có số electron độc thân là
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án đúng là: C
Cấu hình electron của P (Z = 15): 1s22s22p63s23p3.
Sự phân bố các electron vào AO:
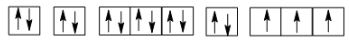
Nguyên tử của nguyên tố phosphorus có số electron độc thân
Nguyên tử của nguyên tố phosphorus (Z = 15) có số electron độc thân là 3.
Bài 2: Hãy xác định số electron độc thân của mỗi nguyên tử Z=20,Z=21,Z=22,Z=24,Z=29 và cho biết sự phân bố electron phân lớp ngoài cùng của chúng.
Lời giải:

+) Z = 20: Trạng thái cơ bản không có e đọc thân, số e phân bố trên phân lớp ngoài cùng là 2e.
+) Z = 21: Trạng thái cơ bản có 1 e độc thân, số e phân bố trên phân lớp ngoài cùng là 2.
+) Z = 22: Trạng thái cơ bản có 2 e độc thân, số e phân bố trên phân lớp ngoài cùng là 2.
+) Z = 24: Trạng thái cơ bản có 6 e độc thân, số e phân bố trên phân lớp ngoài cùng là 1.
+) Z = 29: Trạng thái cơ bản có 1 e độc thân, số e phân bố trên phân lớp ngoài cùng là 1.
