Khái niệm liên kết cho nhận? Cách nhận biết và bài tập về liên kết cho nhận
Khái niệm liên kết cho nhận? Cách nhận biết và bài tập về liên kết cho nhận giúp các bạn biết cách xác định liên kết cho nhận trong các phân tử.
1. Khái niệm liên kết cho nhận là gì?
Liên kết cho – nhận là trường hợp đặc biệt của liên kết cộng hóa trị khi cặp electron dùng chung chỉ do một nguyên tử đóng góp.
- Nguyên tử đóng góp cặp electron là nguyên tử cho, nguyên tử đó phải còn cặp electron chưa liên kết.
- Nguyên tử nhận cặp electron gọi là nguyên tử nhận, , nguyên tử đó phải còn orbital trống, không chứa electron.
- Liên kết cho – nhận biển diễn bằng mũi tên “ → ”, gốc mũi tên là nguyên tử cho, đầu mũi tên là nguyên tử nhận.
2. Điều kiện để có liên kết cho nhận
Điều kiện để có liên kết cho nhận là nguyên tử cho phải có cặp electron chưa tham gia liên kết, nguyện tử nhận phải có obitan trống (hoặc dồn hai electron độc thân lại để tạo ra obitan trống, không có electron).
3. Ví dụ về liên kết cho nhận
Liên kết cho nhận trong phân tử NH3
Trong phân tử NH3, lớp ngoài cùng của nguyên tử N có 5 electron, trong đó có cặp electron chưa liên kết. Ion H+ có orbital trống, không có electron. Khi phân tử NH3 kết hợp với ion H+ , nguyên tử N đóng góp cặp electron chưa liên kết để tạo liên kết với ion H+ tạo thành NH4+. Khi đó, liên kết cho – nhận được hình thành, trong phân tử NH3, nguyên tử N là nguyên tử cho, ion H+ là nguyên tử nhận. Trong ion NH4+ , bốn liên kết N-H hoàn toàn tương đương nhau.
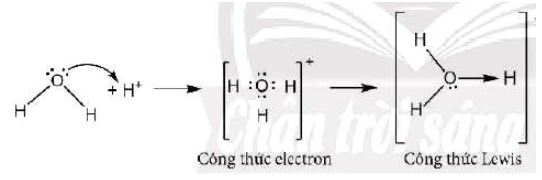
Sự tạo thành liên kết cho - nhận trong ion hydronium H3O+
Trong phân tử H2O, nguyên tử oxygen còn 2 cặp electron chưa liên kết, ion H+ có orbital trống, không chứa electron. Khi cho H2O kết hợp với ion H+ , nguyên tử oxygen sử dụng một cặp electron chưa liên kết làm cặp electron chung với ion H+ tạo thành ion hydronium (H3O+).
Trong ion H3O+, nguyên tử oxygen đóng góp cặp electron chung nên là nguyên tử cho, ion H+ không đóng góp electron, đóng vai trò nhận electron. Tất cả các liên kết O-H trong ion H3O+ là tương đương nhau, nhưng để biểu diễn liên kết cho – nhận hiện diện trong ion, một mũi tên được hướng từ nguyên tử cho sang nguyên tử nhận để phân biệt với các liên kết còn lại: