Lý thuyết KHTN 8 Chân trời sáng tạo Bài 7: Nồng độ dung dịch
Tóm tắt Lý thuyết KHTN 8 Chân trời sáng tạo Bài 7: Nồng độ dung dịch theo chương trình Sách mới ngắn gọn nhất. Tổng hợp lý thuyết Khoa học tự nhiên 8 trọn bộ chi tiết, đầy đủ.
Nồng độ dung dịch
1. Dung dịch
- Dung dịch là hỗn hợp đồng nhất của chất tan và dung môi.
+ Ví dụ: Khi hoà tan đường hay muối (chất rắn) vào nước (chất lỏng) sẽ tạo thành nước đường hay nước muối (hỗn hợp đồng nhất).
2. Độ tan của một chất trong nước
- Độ tan của một chất trong nước là số chất đó hoà tan trong 100 gam gam tối đa nước để tạo thành dung dịch bão hoà ở một nhiệt độ, áp suất xác định.
- Để biểu thị khối lượng chất tan trong một khối lượng dung môi, người ta dùng khái niệm độ tan, tính theo công thức sau:
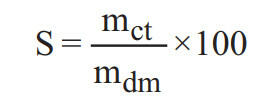
* Trong đó:
+ S là độ tan (đơn vị gam/100 gam nước);
+ mct là khối lượng chất tan (đơn vị gam);
+ mdm là khối lượng dung môi (đơn vị gam).
3. Nồng độ dung dịch
a. Tính đồng nộ phần trăm của dung dịch
- Nồng độ phần trăm của dung dịch là đại lượng cho biết số gam chất tan có trong 100 gam dung dịch.
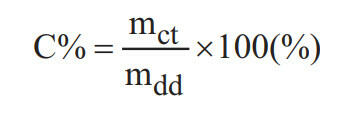
* Trong đó:
+ mct: khối lượng chất tan (đơn vị gam);
+ mdd: khối lượng dung dịch (đơn vị gam).
- Nồng độ mol của dung dịch là đại lượng cho biết số mol chất tan có trong một lít dung dịch.
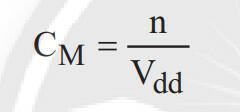
* Trong đó:
+ n: số mol chất tan (đơn vị mol);
+ Vdd: thể tích dung dịch (đơn vị lít, L); dd
+ CM: nồng độ mol của dung dịch (đơn vị mol/L hoặc M).
4. Pha chế dung dịch
- Để pha chế một dung dịch có nồng độ cho trước, ta cần phải biết lượng chất tan (khối lượng hay số mol) cần dùng để hoà tan trong một lượng dung môi.
5. Câu hỏi trắc nghiệm
Câu 1: Số mol trong 400 ml NaOH 6M là
A. 1,2 mol
B. 2,4 mol
C. 1,5 mol
D. 4 mol
Câu 2: Dung dich HCl 25% (D = 1,198 g/ml). Tính CM
A. 8 M
B. 8,2 M
C. 7,9 M
D. 6,5 M
Câu 3: Nghiền nhỏ chất rắn giúp quá trình hòa tan xảy ra nhanh hơn vì
A. nghiền nhỏ chất rắn sẽ làm các phân tử nước chuyển động nhanh hơn.
B. nghiền nhỏ chất rắn sẽ làm gia tăng diện tích tiếp xúc giữa chất rắn với các phân tử nước.
C. nghiền nhỏ chất rắn sẽ làm giảm diện tích tiếp xúc giữa chất rắn với các phân tử nước.
D. nghiền nhỏ chất rắn sẽ làm các phân tử dung môi chuyển động nhanh hơn
Câu 4: Chọn câu đúng
A. Dung dịch là hợp chất đồng nhất của dung môi và chất tan
B. Nước đừơng không phải là dung dịch
C. Dầu ăn tan được trong nước
D. Có 2 cách để chất rắn hòa tan trong nước
Câu 5: Khi cho đường vào nước rồi đun lên, độ tan của đường trong nước sẽ thay đổi như thế nào?
A. Tăng lên
B. Giảm đi
C. Không đổi
D. Không xác định được
Câu 6: Chọn đáp án sai
A. Dung dịch là hợp chất đồng nhất của dung môi và chất tan
B. Xăng là dung môi của dầu ăn
C. Nước là dung môi của dầu ăn
D. Chất tan là chất bị tan trong dung môi
Câu 7: Xăng có thể hòa tan
A. Nước
B. Dầu ăn
C. Muối biển
D. Đường
Câu 8: Ở nhiệt độ 25oC, khi cho 12 gam muối X vào 20 gam nước, khuấy kĩ thì còn lại 5 gam muối không tan. Tính độ tan của muối X.
A. 35
B. 36
C. 37
D. 38
Câu 9: Kí hiệu nồng độ mol:
A. CM
B. CM
C. MC
D. MC
Câu 10: Độ tan là gì?
A. Số kilogam chất đó tan được trong một lít nước để tạo ra dung dich bão hòa để nhiệt độ xác định
B. Là số gam chất đó tan ít nhất trong 100 g nước để tạo thành dung dich bão hòa ở nhiệt độ xác định
C. Là số gam chất đó tan nhiều nhất trong 100 g nước để tạo thành dung dich bão hòa nhiệt độ xác định
D. Là số gam chất đó không tan trong 100 g nước để tạo thành dung dich bão hòa ở nhiệt độ xác định
>>> Xem toàn bộ:
Lý thuyết Khoa học tự nhiên 8 Chân trời sáng tạo
-----------------------------
Trên đây Toploigiai đã cùng các bạn Tóm tắt Lý thuyết KHTN 8 Chân trời sáng tạo Bài 7: Nồng độ dung dịch theo chương trình Sách mới ngắn gọn nhất. Mời các bạn hãy click ngay vào trang chủ Toploigiai để tham khảo và chuẩn bị bài cho năm học mới Lớp 11 nhé. Chúc các bạn học tốt.
