Lý thuyết KHTN 8 Bài 8 Kết nối tri thức
Tóm tắt Lý thuyết Khoa học tự nhiên 8 Kết nối tri thức Bài 8. Acid theo chương trình Sách mới ngắn gọn nhất. Tổng hợp lý thuyết Khoa học tự nhiên 8 trọn bộ chi tiết, đầy đủ
Bài 8. Acid
Soạn KHTN 8 Kết nối tri thức Bài 8: Acid
I. Khái niệm Acid
- Acid ban đầu được biết đến là những chất có vị chua như acetic acid có trong giấm ăn, citric acid có trong quả chanh, malic acid có trong quả táo.
-Từ acid xuất phát từ tiếng Latin là acidus – nghĩa là vị chua.
- Khái niệm về acid được phát biểu như sau: Acid là những hợp chất trong phân tử có nguyên tử hydrogen liên kết với gốc acid. Khi tan trong nước, acid tạo ra ion H+.
- Gốc acid trong các acid sau là: H (Hydrogen), H2SO4 (Sulfuric acid), HCl (Hydrochloric acid), HNO3 (Nitric acid).
II. Tính chất hoá học
- Acid thường tan được trong nước, dung dịch acid làm đổi màu giấy quỳ từ tim sang đồ. Khi dung dịch acid phản ứng với một số kim loại như magnesium, cắt, kẽm... nguyên tử hydrogen của acid được thay thế bằng nguyên tử kim loại để tạo thành muối và giải phóng ra khí hydrogen.
- Tính chất của dung dịch hydrochloric acid:
+ Chuẩn bị: dung dịch HCl 1 M, giấy quỳ tím; hai ống nghiệm mỗi ống đựng một trong các kim loại Fe, Zn, ông hút nhỏ giọt.
+ Thực hiện: Nhỏ 1 – 2 giọt dung dịch HCl vào máu giấy quỳ tím. Cho khoảng 3 mL dung dịch HCl vào mỗi ống nghiệm đã chuẩn bị ở trên.
+ Mô tả hiện tượng xảy ra và viết phương trình hoá học
+ Phản ứng giữa dung dịch HCl và kim loại Mg: Mg + 2HCl → MgCl2 + H2.
III. Một số acid thông dụng
1. Sulfuric acid
- Sulfuric acid (H2SO4) là chất lỏng không màu, không bay hơi, snh như dầu ăn, nặng gần gấp hai lần nước. Sulfuric acid tan vô hạn trong nước và toả rất nhiều nhiệt.
- Lưu ý: Tuyệt đối không tự ý pha loãng dung dịch sulfuric acid đặc.
- Sulfuric acid là một trong các hoá chất được sử dụng nhiều trong các ngành công nghiệp (Hình 8.1) và là hoá chất được tiêu thụ nhiều nhất trên thế giới.
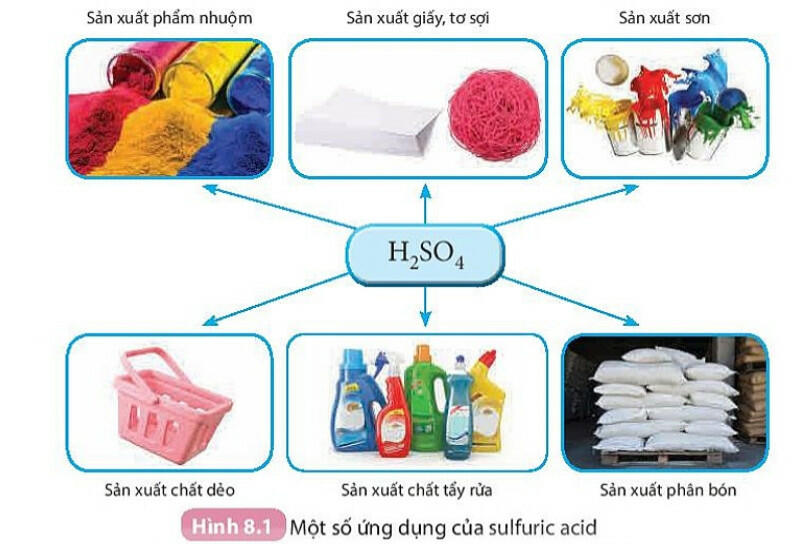
2. Hydrochloric acid
- Dung dịch hydrochloric acid (HCl) là chất lỏng không màu.
- Hydrochloric acid được sử dụng nhiều trong các ngành công nghiệp (Hình 8.2)

3. Acetic acid
- Acetic acid (CH3COOH) là chất lỏng không màu, có vị chua. Trong giấm ăn có chứa acetic acid với nồng độ 2 – 5%.
IV. Trắc nghiệm Khoa học tự nhiên 8 Kết nối tri thức Bài 8 (có đáp án)
Câu 1: Hoà tan hết 3,6 g một kim loại hoá trị II bằng dung dịch H2SO4 loãng được 3,719 lít H2 (đktc). Kim loại là:
A. Zn .
B. Mg.
C. Fe.
D. Ca.
Giải thích:
Nkhí = 3,36 : 22,4 = 0,15 mol
Gọi kim loại là R (hóa trị II)
R + H2SO4 (loãng) → RSO4 + H2
0,15 ← 0,15 mol
→ MR = 3,6/0,15 = 24 (g/mol)
Vậy kim loại cần tìm là Magie (Mg).
Câu 2: Cho 1,08 gam nhôm tác dụng với hydrochloric acid dư, sau phản ứng thu được V lít khí H2 ở đktc. Giá trị của V là
A. 2,479 lít
B. 1,487 lít
C. 3,719 lít
D. 4,958 lít
Câu 3: Ứng dụng của hydrochloric acid là:
A. Sản xuất giấy, tơ sợi
B. Sản xuất chất dẻo
C. Sản xuất ắc quy
D. Sản xuất sơn
Câu 4: Acetic acid là một acid hữu cơ có trong giấm ăn với nồng độ khoảng:
A. 5%
B. 6%
C. 8%
D. 4%
Giải thích:
Acetic acid là một acid hữu cơ có trong giấm ăn với nồng độ khoảng 4% theo thể tích. Điều đó cho ta thấy ngoài nước, acid acetic là một thành phần chính trong giấm.
Câu 5: Để an toàn khi pha loãng H2SO4 đặc cần thực hiện theo cách:
A. Cho cả nước và axit vào cùng một lúc
B. Rót từng giọt nước vào axit
C. Rót từ từ axit vào nước và khuấy đều
D. Cả 3 cách trên đều được.
Giải thích:
Để an toàn khi pha loãng H2SO4 đặc cần thực hiện rót từ từ axit vào nước và khuấy đều, vì axit sunfuric phản ứng cực mạnh với nước nên người ta phải pha loãng H2SO4 để sử dụng.
>>> Xem toàn bộ: Lý thuyết Khoa học tự nhiên 8 Kết nối tri thức
-------------------------------------------
Trên đây Toploigiai đã cùng các bạn Lý thuyết Khoa học tự nhiên 8 Kết nối tri thức Bài 8. Acid theo chương trình Sách mới ngắn gọn nhất. Mời các bạn hãy click ngay vào trang chủ Toploigiai để tham khảo và chuẩn bị bài cho năm học mới Lớp 8 nhé. Chúc các bạn học tốt.
