Lý thuyết Hóa 11 Bài 45. Axit cacboxylic
Lý thuyết Hóa 11 Bài 45. Axit cacboxylic

I. ĐỊNH NGHĨA, PHÂN LOẠI, DANH PHÁP
1.Định nghĩa
Axit cacboxylic là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro.
Ví dụ: H-COOH; C2H5−COOH; HOOC-COOH; ...
Nhóm cacboxyl (-COOH) là nhóm chức của axit cacboxylic.
2.Phân loại
Dựa theo đặc điểm cấu tạo của gốc hiđrocacbon và số nhóm cacboxyl trong phân tử, các axit được chia thành:
a)Axit no, đơn chức, mạch hở
Phân tử có gốc ankyl hoặc nguyên tử hiđro liên kết với một nhóm -COOH. Các axit này lập thành dãy đổng đẳng các axit no, đơn chức, mạch hở có công thức cấu tạo thu gọn chung CnH2n+1COOH (với n⩾0) hoặc công thức phân tử chung CmH2mO2(m⩾1).
Ví dụ: HCOOH; CH3−COOH;...
b) Axit không no, đơn chức, mạch hở
Phân tử có gốc hiđrocacbon không no, mạch hở liên kết với một nhóm -COOH.
Ví dụ:
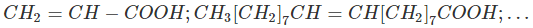
c) Axit thơm, đơn chức
Phân tử có gốc hiđrocacbon thơm liên kết với một nhóm -COOH.
Ví dụ:
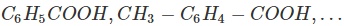
d)Axit đa chức
Nếu phân tử có hai hay nhiều nhóm -COOH, chúng được gọi là axit đa chức.
Ví dụ: Axit ađipic HOOC−[CH2]4−COOH , axit malonic HOOC−CH2−COOH,... thuộc loại axit no, hai chức, mạch hở.
Sau đây ta chỉ xét axit no, đơn chức, mạch hở.
3.Danh pháp
Tên thay thế của các axit no, đơn chức, mạch hở được cấu tạo như sau:
Axit + tên hiđrocacbon no tương ứng với mạch chính + oic
Mạch chính của phân tử axit là mạch cacbon dài nhất bắt đầu từ nhóm -COOH
Mạch cacbon được đánh số bắt đầu từ nguyên tử cacbon của nhóm -COOH.
Một số axit có tên thông thường liên quan đến nguổn gốc tìm ra chúng.
Ví dụ:

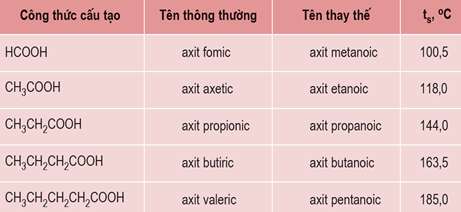
Tên của một số axit no, đơn chức, mạch hở trong bảng sau:
II. ĐẶC ĐIỂM CẤU TẠO
Nhóm cacboxyl có cấu tạo:
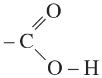
Như vậy, nhóm -COOH coi như được kết hợp bởi nhóm C=O và nhóm OH. Liên kết O-H trong phân tử axit phân cực hơn liên kết O-H trong phân tử ancol, do đó nguyên tử H của nhóm -COOH linh động hơn nguyên tử H của nhóm -OH ancol. Liên kết của nhóm cacboxyl phân cực mạnh hơn liên kết
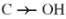
ancol và phenol nên nhóm OH của axit cacboxylic cũng có thể bị thay thế.
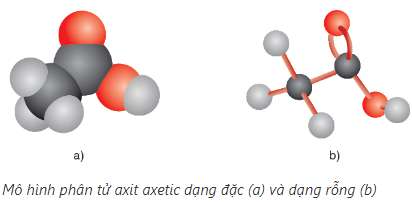
III. TÍNH CHẤT VẬT LÍ
Các axit đều là chất lỏng hoặc chất rắn ở điều kiện thường. Nhiệt độ sôi của các axit tăng theo chiều tăng của phân tử khối và cao hơn nhiệt độ sôi của các ancol có cùng phân tử khối. Nguyên nhân là giữa các phân tử axit có liên kết hiđro bền hơn liên kết hiđro giữa các phân tử ancol.
Axit fomic, axit axetic tan vô hạn trong nước. Độ tan trong nước của các axit giảm dần theo chiều tăng của phân tử khối.
Mỗi axit có vị riêng: axit axetic có vị giấm ăn, axit oxalic có vị chua của me, ...
IV. TÍNH CHẤT HOÁ HỌC
Axit cacboxylic dễ dàng tham gia các phản ứng thế hoặc trao đổi nguyên tử H hoặc nhóm -OH của nhóm chức -COOH.
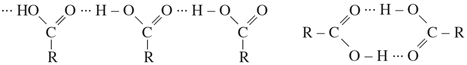
1.Tính axit
a)Trong dung dịch, axit cacboxylic phân li thuận nghịch
Ví dụ:
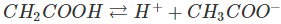
Dung dịch axit cacboxylic làm quỳ tím chuyển thành màu đỏ.
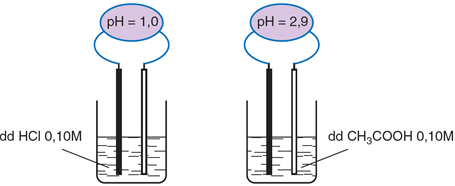
HCl là axit mạnh, phân li hoàn toàn; CH3COOH là axit yếu, phân li một phần
b)Tác dụng với bazơ, oxit bazơ tạo thành muối và nước
Ví dụ:
CH3COOH + NaOH → CH3COONa + H2O
c)Tác dụng với muối
Nhỏ dung dịch axit axetic vào đá vôi, thấy có khí CO2 thoát ra:
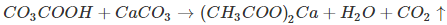
d)Tác dụng với kim loại trước hiđro trong dãy hoạt động hoá học của các kim loại tạo thành muối và giải phóng hiđro
Ví dụ, ngâm một lá kẽm mỏng trong dung dịch axit axetic, thấy có bọt khí hiđro thoát ra:
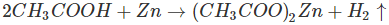
2. Phản ứng thế nhóm −OH
Đun sôi hỗn hợp gồm axit cacbonxylic RCOOH,, ancol R′OH (có vài giọt H2SO4 đặc làm xúc tác) một thời gian (khoảng 6-8 giờ)
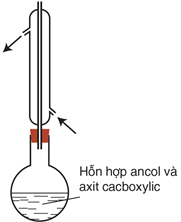
Để nguội, sau đó pha loãng hỗn hợp bằng một lượng lớn nước cất, chất lỏng tách thành 2 lớp: lớp phía trên có mùi thơm nhẹ. Đó là este sinh ra do phản ứng giữa axit và ancol:
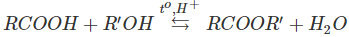
Ví dụ:
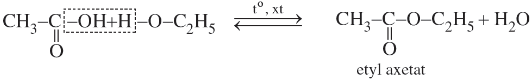
Phản ứng giữa ancol và axit tạo thành este và nước được gọi là phản ứng este hoá. Đặc điểm của phản ứng este hoá là thuận nghịch và cần axit H2SO4 đặc làm chất xúc tác.
V. ĐIỀU CHẾ
1.Phương pháp lên men giấm là phương pháp cổ truyền sản xuất axit axetic. Thực chất của quá trình là oxi hoá ancol etylic bằng oxi không khí nhờ chất xúc tác men giấm:
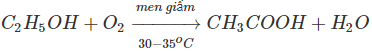
Ngày nay, phương pháp này chỉ dùng sản xuất lượng nhỏ axit axetic để làm giấm ăn.
2.Oxi hoá anđehit axetic (điều chế từ etilen hoặc axetilen) trước đây là phương pháp chủ yếu để sản xuất axit axetic:
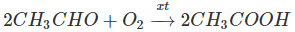
3.Oxi hoá ankan
Oxi hoá butan thu được axit axetic
Oxi hoá không hoàn toàn các ankan có mạch cacbon dài để tổng hợp các axit có phân tử khối lớn.
4.Từ metanol
Cho metanol tác dụng với cacbon oxit (có chất xúc tác thích hợp) thu được axit axetic
Đây là phương pháp hiện đại sản xuất axit axetic.
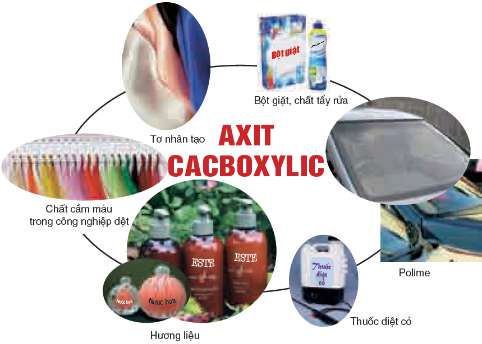
VI.ỨNG DỤNG
Các axit hữu cơ có ứng dụng trong nhiều lĩnh vực: làm nguyên liệu cho công nghiệp mĩ phẩm, công nghiệp dệt, công nghiệp hoá học, ...
Xem thêm Giải Hóa 11: Bài 45. Axit cacboxylic
