Tóm tắt Lý thuyết Hóa 10 Kết nối tri thức Bài 9
Tóm tắt Lý thuyết Hóa học 10 Kết nối tri thức Bài 9: Ôn tập chương II theo chương trình Sách mới ngắn gọn nhất. Tổng hợp lý thuyết Hóa học 10 trọn bộ chi tiết, đầy đủ.
Bài 9: Ôn tập chương II
1. Cấu tạo bảng tuần hoàn
Bảng tuần hoàn chứa 118 nguyên tố hóa học được sắp xếp theo các nguyên tắc sau:
+ Các nguyên tố được sắp xếp theo chiều tăng dần điện tích hạt nhân nguyên tử.
+ Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
+ Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp thành một cột.
a. Ô nguyên tố
- Mỗi nguyên tố hóa học được xếp vào một ô trong bảng tuần hoàn các nguyên tố hóa học, gọi là ô nguyên tố.
- Số thứ tự của một ô nguyên tố bằng số hiệu nguyên tử của nguyên tố hóa học trong ô đó.
b. Chu kì
- Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần.
- Số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố trong chu kì. Bảng tuần hoàn gồm 7 chu kì:
+ Các chu kì 1, 2 và 3 là các chu kì nhỏ.
+ Các chu kì 4, 5, 6 và 7 là các chu kì lớn.
c. Nhóm nguyên tố
- Nhóm nguyên tố gồm các nguyên tố mà nguyên tử của chúng có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột.
- Bảng tuần hoàn hiện nay có 18 cột, chia thành 8 nhóm A (IA đến VIIIA) và 8 nhóm B (IB đến VIIIB). Mỗi cột tương ứng với một nhóm, riêng nhóm VIIIB có 3 cột.
2. Xu hướng biến đổi trong bảng tuần hoàn
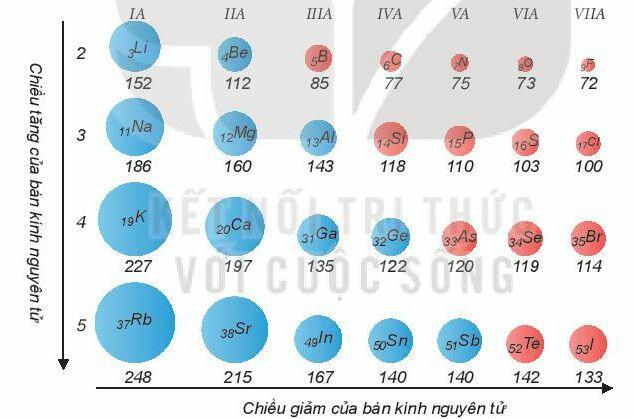
a) Bán kính nguyên tử
- Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
- Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
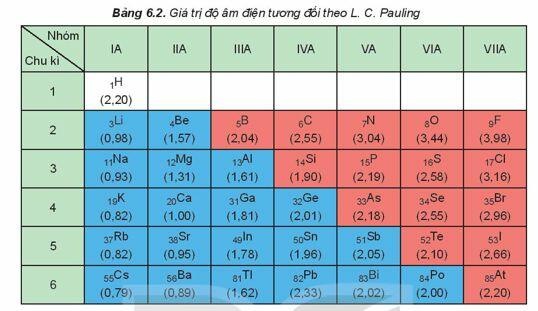
b) Giá trị độ âm điện
Xu hướng biến đổi độ âm điện theo chiều tăng dần của điện tích hạt nhân:
- Độ âm điện tăng từ trái qua phải trong một chu kì.
- Độ âm điện giảm từ trên xuống dưới trong một nhóm A.
c) Tính kim loại, tính phi kim
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần.
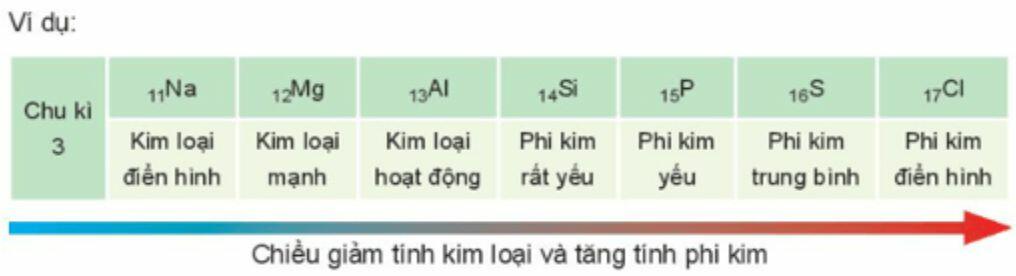
- Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần.

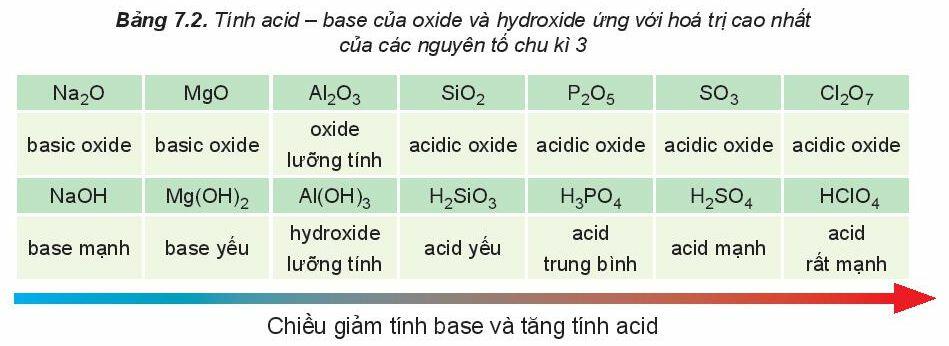
d) Tính acid – base của các oxide và hydroxide
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
3. Bảng tuần hoàn và cấu tạo nguyên tử
- Có thể dự đoán được tính chất hóa học của các nguyên tố khi biết vị trí của nó trong bảng tuần hoàn các nguyên tố hóa học hay cấu hình electron của nó (và ngược lại)

- Chú ý:
+ Số Z = số proton = số electron = số hiệu nguyên tử
+ Số lớp electron = số thứ tự chu kì
+ Số electron lớp ngoài cùng = số thứ tự nhóm A
4. Định luật tuần hoàn
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
>>> Xem toàn bộ:
- Lý thuyết Hóa 10 Kết nối tri thức
- Soạn Hóa 10 Kết nối tri thức
- Sơ đồ tư duy Hóa 10 Kết nối tri thức
- Trắc nghiệm Hóa 10 Kết nối tri thức
-------------------------------------------
Trên đây Toploigiai đã cùng các bạn Tóm tắt Lý thuyết Hóa học 10 Kết nối tri thức Bài 9: Ôn tập chương II theo chương trình Sách mới ngắn gọn nhất. Mời các bạn hãy click ngay vào trang chủ Toploigiai để tham khảo và chuẩn bị bài cho năm học mới Lớp 10 nhé. Chúc các bạn học tốt.
