Tóm tắt Lý thuyết Hóa 10 Kết nối tri thức Bài 13
Tóm tắt Lý thuyết Hóa học 10 Kết nối tri thức Bài 13: Liên kết hydrogen và tương tác van der waals theo chương trình Sách mới ngắn gọn nhất. Tổng hợp lý thuyết Hóa học 10 trọn bộ chi tiết, đầy đủ.
Bài 13: Liên kết hydrogen và tương tác van der waals
I. Mở đầu
- Các tính chất vật lí của các chất có liên kết cộng hóa trị được quyết định bởi:
+ Lực tương tác giữa các phân tử
+ Hình dạng của phân tử
+ Mức độ phân cực của liên kết cộng hóa trị trong phân tử
- Lực tương tác giữa các phân tử yếu hơn rất nhiều so với lực liên kết ion, liên kết CHT hay liên kết kim loại
- Một số tương tác điển hình giữa các phân tử
+ Liên kết hydrogen
+ Tương tác van der Waals
II. Liên kết hydrogen
1. Bản chất của liên kết hydrogen
- Liên kết hydrogen được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia liên kết.
Ví dụ:

- Một số kiểu tạo thành liên kết hydrogen:
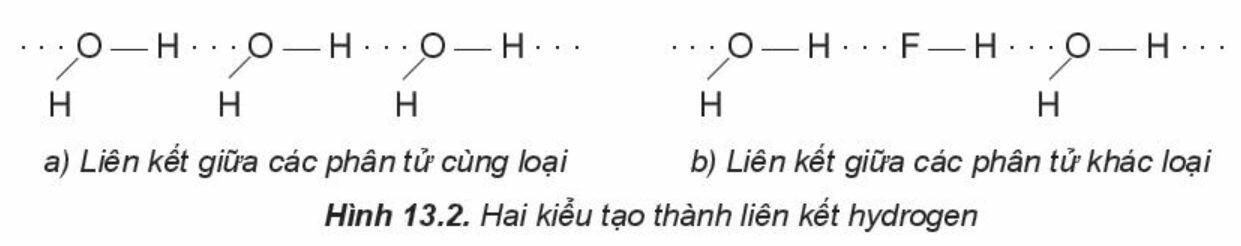
Chú ý:
- Điều kiện cần và đủ để tạo thành liên kết hydrogen:
+ Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn như F, O, N …
+ Nguyên tử F, O, N, … liên kết với hydrogen phải có ít nhất một cặp electron hóa trị chưa liên kết.
2. Vai trò và ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước
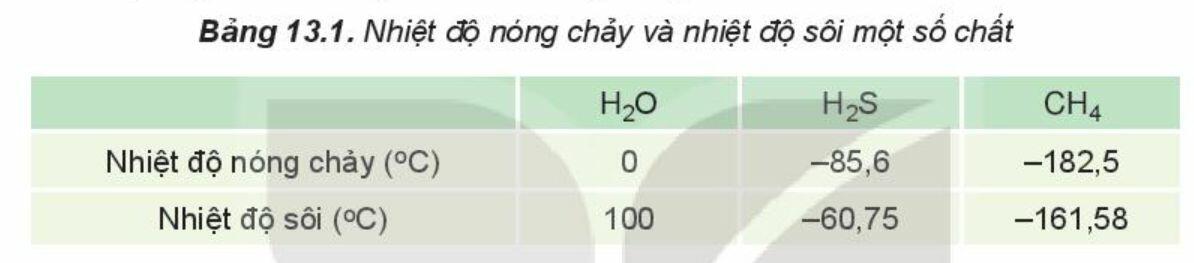
Liên kết hydrogen làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của nước.
Ví dụ: Do ảnh hưởng của liên kết hydrogen nên nhiệt độ nóng chảy và nhiệt độ sôi của H2O cao hơn nhiều so với H2S và CH4.
III. Tương tác van der Waals
1. Khái niệm tương tác van der Waals
- Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử
- Bản chất:
+ Trong phân tử, các electron không ngừng chuyển động. Khi các electron di chuyển tập trung về một phía bất kì của phân tử sẽ hình thành nên các lưỡng cực tạm thời:
+ Các phân tử có lưỡng cực tạm thời cũng có thể làm các phân tử lân cận xuất hiện các lưỡng cực cảm ứng. Do đó, các phân tử có thể tập hợp thành một mạng lưới với tương tác lưỡng cực cảm ứng, được gọi là tương tác van der Waals
2. Ảnh hưởng của tương tác van der Waals đến nhiệt độ nóng chảy, nhiệt độ sôi của các chất
- Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi các chất.
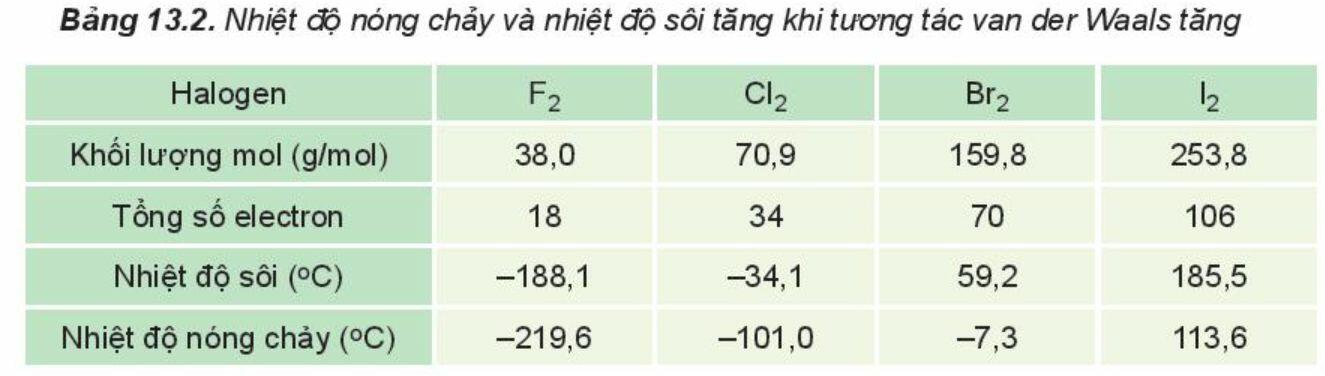
+ Ví dụ 1: Trong dãy halogen, tương tác van der Waals tăng theo sự tăng của số electron (và proton) trong phân tử, làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của các chất.
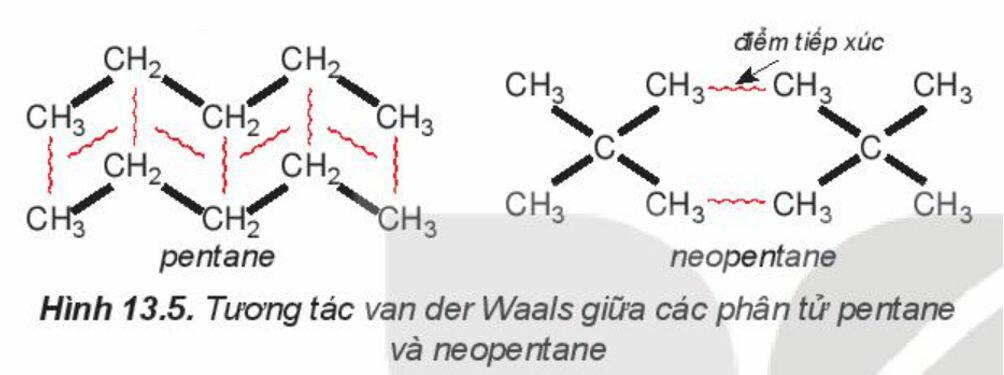
+ Ví dụ 2: Pentane là hydrocarbon no có công thức C5H12. Đồng phân mạch không phân nhánh pantane có nhiệt độ sôi (36oC) cao hơn so với đồng phân mạch nhánh neopentane (9,5oC) do diện tích tiếp xúc giữa các phân tử pentane lớn hơn nhiều so với neopentane.
Chú ý:
Khi khối lượng phân tử tăng thì tương tác van der Waals tăng.
>>> Xem toàn bộ:
- Lý thuyết Hóa 10 Kết nối tri thức
- Soạn Hóa 10 Kết nối tri thức
- Sơ đồ tư duy Hóa 10 Kết nối tri thức
- Trắc nghiệm Hóa 10 Kết nối tri thức
-------------------------------------------
Trên đây Toploigiai đã cùng các bạn Tóm tắt Lý thuyết Hóa học 10 Kết nối tri thức Bài 13: Liên kết hydrogen và tương tác van der waals theo chương trình Sách mới ngắn gọn nhất. Mời các bạn hãy click ngay vào trang chủ Toploigiai để tham khảo và chuẩn bị bài cho năm học mới Lớp 10 nhé. Chúc các bạn học tốt.
