FeS ra SO2 - Phản ứng Sắt (II) sunfua ra lưu huỳnh đioxit
Tổng hợp phương trình Phản ứng Sắt (II) sunfua ra lưu huỳnh đioxit (FeS ra SO2) và một số tính chất của FeS giúp các bạn bổ sung kiến thức về Hóa học.
Phương trình hóa học FeS ra SO2
FeS + O2 → Fe2O3 + SO2
- Điều kiện phản ứng: Nhiệt độ.
- Cách thực hiện phản ứng: FeS bị oxi hóa bởi oxi
- Hiện tượng nhận biết: Xuất hiện mùi hắc Lưu huỳnh đioxit (SO2)
Hệ số cân bằng của phản ứng FeS + O2 → Fe2O3 + SO2
Quá trình cho e và quá trình nhận e là:
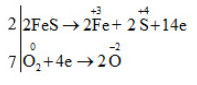
Vậy phương trình hóa học được cân bằng là: 4FeS + 7O2 → 2Fe2O3 + 4SO2
Tổng hệ số cân bằng của phản ứng trên là: 4 + 7 + 2 + 4 = 17.
Mở rộng kiến thức về FeS
Sắt(II) sulfua hoặc sulfide sắt là một trong những hợp chất hóa học và là khoáng chất với công thức hóa học gần đúng là FeS. Hợp chất này là một chất rắn màu đen, không tan trong nước.
Fe + S → FeS
* Tính chất vật lý của FeS
- Là chất rắn, màu đen, không tan trong nước nhưng tan trong dung dịch axit.
- Không gây độc do không tan trong nước.
* Nhận biết: Sử dụng dung dịch HCl, thấy thoát ra khí có mùi trứng thối.
FeS + 2HCl → FeCl2 + H2S
* Tính chất hóa học của FeS
- Có tính chất hóa học của muối.
- Tác dụng với axit:
FeS + 2HCl → FeCl2 + H2S
* Điều chế: Sắt (II) sunfua có thể được điều chế bằng cách cho hai nguyên tố là Fe và S phản ứng với nhau bằng cách đun nóng chúng.
* Ứng dụng: Sắt (II) sunfua có nhiều trong quặng sắt, chủ yếu dùng để điều chế sắt.
