Đề kiểm tra 1 tiết Hóa 10 Chương 6 - Đề 1
Đề kiểm tra 1 tiết Hóa 10 Chương 6 - Đề 1
ĐỀ BÀI
I . Trắc nghiệm (4đ’) :
Hãy chọn đáp án đúng cho mỗi câu sau :
Câu 1: Trong phòng thí nghiệm người ta có thể điều chế oxi bằng cách
A. nhiệt phân các hợp chất giàu oxi B.điện phân nước hoà tan H2SO4.
C. điện phân dung dịch CuSO4. D. chưng phân đoạn không khí lỏng.
Câu 2 : Để pha loãng dung dịch H2SO4 đậm đặc, trong phòng thí nghiệm, người ta tiến hành theo cách nào trong các cách sau đây:
A. Cho từ từ nước vào axit và khuấy đều. B. Cho từ từ axit vào nước và khuấy đều.
C. Cho nhanh nước vào axit và khuấy đều. D. Cho nhanh axit vào nước và khuấy đều.
Câu 3: Oxi và ozon là
A. hai dạng thù hình của oxi B . hai đồng vị của oxi.
C. hai đồng phân của oxi. D. hai hợp chất của oxi.
Câu 4: Để phân biệt oxi và ozon, người ta có thể dùng
A. Cu. B. Ag. C. Au. D. Fe.
Câu 5: Cho FeCO3 tác dụng với H2SO4 đặc nóng, sản phẩm khí thu được gồm có:
A. CO2 và SO2 B. H2S và CO2 C. SO2 D. CO2
Câu 6: Trong các hợp chất hoá học số oxi hoá thường gặp của lưu huỳnh có thể là :
A. 1, 4, 6 B. -2, 0, +2, +4, +6 C. -2, 0, +4, +6 D. kết quả khác
Câu 7: Khi đun nóng hỗn hợp Fe và S thì tạo thành sản phẩm nào sau đây?
A. Fe2S3 B. FeS C. FeS2 D. Cả A và B
Câu 8: Trong công nghiệp, để sản xuất H2SO4 đặc, người ta thu khí SO3 trong tháp hấp thụ bằng
A. H2O. B. H2SO4 98%. C. H2SO4 loãng. D. BaCl2 loãng.
II, Tự luận (6đ’)
Bài 1(2đ’): Hoàn thành sơ đồ phản ứng sau (ghi rõ điều kiện phản ứng nếu có)?
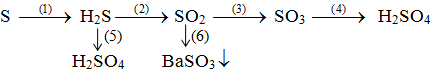
Bài 2(2đ’): Nhận biết các dung dịch sau trong ống nghiệm riêng biệt mất nhãn: H2SO4 , HCl, Na2SO4, BaCl2, NaCl.
Bài 3(2đ’): Hòa tan 12,6 g hỗn hợp Mg và Al trong H2SO4 đặc thấy thoát ra 13,44 lít khí SO2 (ở đktc, là sản phẩm khử duy nhất).
a, Viết các phương trình phản ứng xảy ra.
b, Tính % về khối lượng của mỗi kim loại trong hỗn hợp ban đầu.
Đáp án và thang điểm
I, Phần trắc nghiệm:
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Đáp án |
A |
B |
A |
B |
A |
C |
B |
B |
II, Phần tự luận:
Bài 1:
Mỗi phương trình viết đúng được 0,5 điểm.
Nếu cân bằng phương trình hoá học sai thì trừ 1/2 số điểm của ptrình hoá học đó.
Nếu viết sai công thức hoá học thì không cho điểm phương trình hoá học đó.
Bài 2:
|
Đáp án |
Điểm |
|
- Tách được 2 nhóm HCl, H2SO4 (I) và Na2SO4, BaCl2, NaCl (II) dựa vào quỳ tím. - Nhận biết được H2SO4 dựa vào BaCl2. - Nhận biết được Na2SO4 dựa vào BaCl2. - Nhận biết được BaCl2 dựa vào Na2CO3. |
0,5 điểm
0,5 điểm
0,5 điểm 0,5 điểm |
Bài 3:
|
Đáp án |
Điểm |
|
Mg + 2H2SO4 → MgSO4 + SO2 + 2H2O 2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O Gọi số mol của Mg và Al lần lượt là x, y mol mMg, Al = 24x + 27 y = 12,6 (3) Theo (1), (2): nSO2 = x + 3y/2 = 0,6 (4) Giải hệ (3), (4) Þ x = 0,3; y = 0,2
%mAl = 100% - 57,14% = 42,86%. |
0,25 điểm 0,25 điểm
0,25 điểm
0,25 điểm 0,25 điểm
0,25 điểm
0,25điểm
0,25 điểm |
Tham khảo toàn bộ: Đề kiểm tra, đề thi Hóa 10 học kì 2
