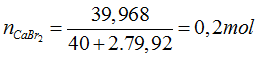Đề kiểm tra 1 tiết Hóa 10 Chương 1 - Đề 9
Đề kiểm tra 1 tiết Hóa 10 Chương 1 - Đề 9
ĐỀ BÀI
Phần 1: Trắc nghiệm khách quan (20 câu - 8,0 điểm)
MỨC ĐỘ BIẾT (6 CÂU)
Câu 1: Phát biểu nào sau đây không đúng?
A. Nguyên tử trung hòa về điện.
B. Nguyên tử có cấu trúc đặc khít.
C. Khối lượng nguyên tử tập trung ở hạt nhân.
D. Vỏ nguyên tử cấu tạo từ các hạt electron.
Câu 2: Cho Na = 22,98. Kết luận nào sau đây đúng?
A. Số khối của hạt nhân nguyên tử là 22,98.
B. Nguyên tử khối là 22,98.
C. Khối lượng nguyên tử là 22,98 gam.
D. Khối lượng mol nguyên tử là 22,98u.
Câu 3: Cặp nguyên tử nào sau đây là đồng vị của cùng một nguyên tố hóa học?
![]()
Câu 4: Dãy nào sau đây gồm các phân lớp electron đã bão hòa?
A. s1, p3, d7, f12.
B. s2, p4, d10, f12.
C. s2, p5, d9, f13.
D. s2, p6, d10, f14.
Câu 5: Số electron tối đa trên lớp L là
A. 2.
B. 8.
C. 18.
D. 32.
Câu 6: Trong nguyên tử, hạt mang điện
A. chỉ có electron.
B. gồm proton và electron.
C. gồm proton và nơtron.
D. gồm electron và nơtron.
MỨC ĐỘ HIỂU (8 CÂU)
Câu 7: Cấu hình electron nguyên tử của hai nguyên tố X, Y lần lượt là: 1s22s22p63s1 và 1s22s22p63s23p3. Kết luận nào sau đây đúng?
A. X, Y đều là kim loại.
B. X là kim loại, Y là phi kim.
C. X là phi kim, Y là kim loại.
D. X, Y đều là phi kim.
Câu 8: Số nguyên tố mà nguyên tử có tổng số electron trên các phân lớp s bằng 7 ở trạng thái cơ bản là
A. 5.
B. 1.
C. 3.
D. 9.
Câu 9: Nguyên tử của hai nguyên tố X, Y có phân mức năng lượng cao nhất lần lượt là 3p và 4s. Tổng số electron trên hai phân lớp này là 7, X không phải là khí hiếm. X, Y lần lượt là
A. Cl (Z=17) và Ca (Z=20).
B. Br (Z=35) và Mg (Z=12).
C. Cl (Z=17) và Sc (Z=21).
D. Cl (Z=17) và Zn (Z=30).
Câu 10: Nguyên tử của nguyên tố X có tổng số electron trên các phân lớp p là 7. X là
A. Al (Z=13).
B. Cl (Z=17).
C. P (Z=15).
D. Si (Z=14).
Câu 11: Nhận định nào sau đây đúng về ?
A. Hạt nhân nguyên tử có 3 proton và 7 nơtron.
B. Số khối của hạt nhân nguyên tử là 3, số hiệu nguyên tử là 7.
C. Nguyên tử có 3 electron, hạt nhân có 3 proton và 4 nơtron.
D. Nguyên tử có 3 electron, hạt nhân có 4 proton và 3 nơtron.
Câu 12: Nguyên tử của nguyên tố R có 3 lớp electron, lớp ngoài cùng có 6 electron. Số hiệu nguyên tử của R là
A. 15.
B. 16.
C. 14.
D. 19.
Câu 13: Trong tự nhiên, hiđro có 3 đồng vị bền và clo có 2 đồng vị bền. Số kiểu phân tử hiđro clorua khác nhau tạo thành từ các đồng vị trên là
A. 6.
B. 9.
C. 12.
D. 3.
Câu 14: Cấu hình electron không đúng là
A. 1s22s22p5.
B. 1s22s22p63s23p5.
C. 1s22s22p63s23p34s2.
D. 1s22s22p63s2.
MỨC ĐỘ VẬN DỤNG (6 CÂU)
Câu 15: Nguyên tử X có tổng số hạt proton, electron và nơtron bằng 34 và số khối là 23. Số lớp electron và số electron lớp ngoài cùng của X lần lượt là
A. 3 và 1.
B. 2 và 1.
C. 4 và 1.
D. 1 và 3.
Câu 16: Nguyên tử X có 3 lớp electron, lớp ngoài cùng có 2 electron. Phát biểu nào sau đây không đúng?
A. X là nguyên tố p.
B. Điện tích hạt nhân của nguyên tử X là 12+.
C. Ở trạng thái cơ bản, các phân lớp electron của X đã bão hòa.
D. X là nguyên tố kim loại.
Câu 17: Khối lượng nguyên tử Na là 38,1643.10–27 kg và theo định nghĩa 1u = 1,6605.10–27 kg. Khối lượng mol nguyên tử Na (g/mol) và khối lượng nguyên tử Na (u) lần lượt là
A. 23 và 23.
B. 22,98 và 23.
C. 22,98 và 22,98.
D. 23 và 22,98.
Câu 18: Phát biểu nào sau đây không đúng?
A. Hạt nhân nguyên tử không chứa nơtron.
B. Nguyên tử H có 1 electron duy nhất nên chuyển động theo một quĩ đạo duy nhất.
C. Nguyên tử có số hạt không mang điện nhiều hơn số hạt mang điện dương là 4.
D. Hạt nhân nguyên tử có số nơtron gấp đôi số proton.
Câu 19: Bo có hai đồng vị 10B và 11B với nguyên tử khối trung bình là 10,81. Xem nguyên tử khối mỗi đồng vị có giá trị bằng số khối. Phần trăm số nguyên tử đồng vị 11B là
A. 81%.
B. 40,5%.
C. 19%.
D. 59,5%.
Câu 20: Phân tử X2Y có tổng số hạt mang điện là 44. Số hạt mang điện của X bằng 4/3 lần số hạt mang điện của Y. Cấu hình electron của Y là
A. 1s22s22p2.
B. 1s22s22p3.
C. 1s22s22p4.
D. 1s22s22p5.
Phần 2: Tự luận (2 câu - 2,0 điểm)
Câu 1: Nguyên tử nguyên tố X có số hiệu nguyên tử là 17.
a. Viết cấu hình electron của nguyên tử nguyên tố X.
b. X là nguyên tố kim loại, phi kim hay khí hiếm? Vì sao?
Câu 2: Trong tự nhiên, brom có 2 đồng vị:79Br và 81Br với nguyên tử khối trung bình là 79,92. Tính số nguyên tử 81Br trong 39,968 gam CaBr2. (Cho Ca=40, số Avogađro có giá trị 6,023.1023 và xem nguyên tử khối mỗi đồng vị có giá trị bằng số khối).
ĐÁP ÁN
Phần 1: Trắc nghiệm : 20x0,4 = 8,0 điểm
Phần 2: Tự luận: 2x1,0 = 2,0 điểm
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
||
|
B |
B |
C |
D |
B |
B |
B |
C |
A |
A |
C |
B |
A |
C |
A |
A |
C |
B |
A |
A |
||
|
Câu |
Đáp án |
Điểm |
|||||||||||||||||||
|
1 |
Viết đúng cấu hình electron |
0,5 |
|||||||||||||||||||
|
Xác định X là phi kim |
0,25 |
||||||||||||||||||||
|
Giải thích có 6 electron lớp ngoài cùng |
0,25 |
||||||||||||||||||||
|
2 |
Xác định % số nguyên tử 81Br bằng 46% |
0,25 |
|||||||||||||||||||
|
Tính đúng |
0,25 |
||||||||||||||||||||
|
Số nguyên tử 81Br = 0,2.2.0,46.6,023.1023 = 1,108.1023 |
0,5 |
||||||||||||||||||||