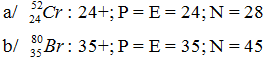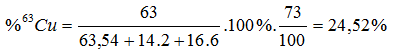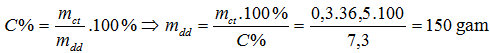Đề kiểm tra 1 tiết Hóa 10 Chương 1 - Đề 6
Đề kiểm tra 1 tiết Hóa 10 Chương 1 - Đề 6
ĐỀ BÀI
I. TRẮC NGHIỆM: (3,0 điểm)
Câu 1: Hầu hết các nguyên tử được cấu tạo từ các hạt
A. e.
B. e, n.
C. e, p, n.
D. p, n.
Câu 2: Nguyên tử nguyên tố X có 13 electron. Điện tích hạt nhân của X là
A. 12.
B. 13-.
C. 13.
D. 13+.
Câu 3: Nguyên tử Y có số e là 15 và số n là 16. Số khối là
A.
B. 15.
C. 16.
D. 30.
Câu 4: Số proton, nơtron, electron trong nguyên tử ![]() lần lượt là
lần lượt là
A. 17, 35, 18.
B. 17, 18, 18.
C. 35, 17, 18.
D. 17, 20, 17.
Câu 5: Oxi có 3 đồng vị![]() , và cacbon có 2 đồng vị
, và cacbon có 2 đồng vị ![]() . Có thể tạo ra số phân tử cacbon monooxit (CO) là
. Có thể tạo ra số phân tử cacbon monooxit (CO) là
A. 3.
B. 9.
C. 6.
D. 12.
Câu 6: Nguyên tố Argon có 3 đồng vị ![]() . Nguyên tử khối trung bình của Argon là
. Nguyên tử khối trung bình của Argon là
A. 39,75.
B. 37,55.
C. 39,99.
D. 38,25.
Câu 7: Nguyên tử nguyên tố X có tổng số hạt p, n và e là 60. Trong đó, số hạt mang điện âm bằng số hạt không mang điện. Số khối của X là
A. 30.
B. 20.
C. 60.
D. 40.
Câu 8: Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là
A. 2, 8, 18, 32.
B. 2, 6, 10, 14.
C. 2, 6, 8, 18.
D. 2, 4, 6, 8.
Câu 9: Cho S (Z = 16), cấu hình electron nguyên tử của lưu huỳnh là
A. 1s2 2s2 2p6 3s2 3p2.
B. 1s2 2s2 2p6 3s2 3p5.
C. 1s2 2s2 2p6 3s2 3p4.
D. 1s2 2s2 2p6 3s2 3p6.
Câu 10: Cấu hình electron của Mg2+ (Z = 12) là
A. 1s²2s²2p63s²
B. 1s²2s²2p6.
C. 1s²2s²2p63s²3p².
D. 1s²2s²2p63s²3p6.
Câu 11: Nguyên tử P (Z = 15) có số e ở lớp ngoài cùng là
A. 3.
B. 4.
C. 5.
D. 8.
Câu 12: Số e độc thân của Mn (Z = 25) là
A. 1
B. 2.
C. 3.
D. 5.
II. TỰ LUẬN: (7,0 điểm)
Câu 1 (1,0 điểm): Hãy cho biết: điện tích hạt nhân, số proton, số electron và số nơtron của các nguyên tử sau:
a/ ![]()
b/ ![]()
Câu 2 (0,5 điểm): Cho kí hiệu nguyên tử ![]() . Tính khối lượng nguyên tử theo đơn vị gam. Biết me=9,1094.10-31 kg; mp=1,6726.10-27 kg; mn=1,6748.10-27 kg.
. Tính khối lượng nguyên tử theo đơn vị gam. Biết me=9,1094.10-31 kg; mp=1,6726.10-27 kg; mn=1,6748.10-27 kg.
Câu 3 (1,0 điểm): Cho X (Z = 17)
a/ Viết cấu hình electron nguyên tử của X?
b/ X có bao nhiêu lớp electron?
c/ X là nguyên tố s, p, d hay f?
d/ X là kim loại, phi kim hay khí hiếm? Vì sao?
Câu 4 (0,5 điểm): Ở trạng thái cơ bản, nguyên tử nguyên tố Y có 8 electron trên các phân lớp p. Viết cấu hình electron nguyên tử của Y và cho biết Y là kim loại, phi kim hay khí hiếm?
Câu 5 (1,5 điểm): Nguyên tố đồng có hai đồng vị bền ![]() . Biết nguyên tử khối trung bình của đồng là 63,54. Tính phần trăm hàm lượng của đồng vị 63Cu trong Cu(NO3)2 (cho O=16, N=14).
. Biết nguyên tử khối trung bình của đồng là 63,54. Tính phần trăm hàm lượng của đồng vị 63Cu trong Cu(NO3)2 (cho O=16, N=14).
Câu 6 (1,0 điểm): Biết tổng số hạt proton, electron và nơtron trong một nguyên tử của nguyên tố X là 34. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt.
a/ Cho biết tên X? Viết kí hiệu nguyên tử của nguyên tố X?
b/ Viết cấu hình electron nguyên tử của X?
Câu 7 (1,5 điểm): Hòa tan hoàn toàn 4,4 gam hỗn hợp gồm (Mg, MgO) bằng dung dịch axit HCl 7,3% vừa đủ. Sau khi phản ứng kết thúc thu được 2,24 lít khí ở đktc. (cho biết H = 1; O = 16; Mg = 24; Cl = 35,5)
a) Viết PTHH.
b) Tính khối lượng Mg và MgO trong hỗn hợp đầu.
c) Tính khối lượng dung dịch axit HCl 7,3% đã dùng.
ĐÁP ÁN
I. TRẮC NGHIỆM: (3,0 điểm)
|
1. C |
2. D |
3. A |
4. D |
5. C |
6. C |
|
7. D |
8. B |
9. C |
10. B |
11. C |
12. D |
II. TỰ LUẬN: (7,0 điểm)
|
Câu |
Nội dung |
Điểm |
|
Câu 1 (1,0đ) |
|
0,5
0,5 |
|
Câu 2 (0,5đ) |
mnguyên tử = 8. 9,1094.10-31 + 8.1,6726.10-27 + 8.1,6748.10-27 = 26,7865.10-27 kg = 26,7865.10-24 gam |
0,25
0,25 |
|
Câu 3 (1,0đ) |
X (Z = 17): a/ Cấu hình electron nguyên tử của X: 1s2 2s2 2p6 3s2 3p5 b/ X có 3 lớp electron. c/ X là nguyên tố p. d/ X là phi kim vì có 7e lớp ngoài cùng |
0,25 0,25 0,25 0,25 |
|
Câu 4 (0,5đ) |
Y có 8e ở phân lớp p - Cấu hình electron nguyên tử của Y: 1s2 2s2 2p6 3s2 3p2 - Y là phi kim vì có 4e lớp ngoài cùng, nguyên tử có 3 lớp. |
0,25 0,25 |
|
Câu 5 (1,5đ) |
- Gọi a là phần trăm số nguyên tử của đồng vị b là phần trăm số nguyên tử của đồng vị - Ta có: a + b = 100 (1) - Mà: A (Cu) = (a.X + b.Y)/100 ⇔ 63,54 = (63a + 65b)/100 (2) - Giải hệ phương trình (1) và (2), ta được: a= 73; b=27. |
0,5 0,5 |
|
- Phần trăm hàm lượng của đồng vị 63Cu trong Cu(NO3)2:
|
0,5 |
|
|
Câu 6 (1,0đ) |
a) - Gọi số proton là P thì số electron cũng là P. Gọi số nơtron là N. Ta có: 2P + N = 34 (1) - Theo bài ra, ta lại có: 2P – N = 10 (2) Từ (1) và (2), suy ra: P=11; N=12; A = 23 (Na) - Kí hiệu nguyên tử: |
0,5 0,25 |
|
b) Cấu hình electron nguyên tử của Na: 1s2 2s2 2p6 3s1 |
0,25 |
|
|
Câu 7 (1,5đ) |
a) PTHH: Mg + 2HCl → MgCl2 + H2↑ (1) MgO + 2HCl → MgCl2 + H2O (2) |
0,25 0,25 |
|
b) Tính khối lượng Mg và MgO trong hỗn hợp đầu: - Theo (1): nMg = nH2 = 0,1 mol → mMg = 24.0,1 = 2,4 gam → mMgO = 4,4 – 2,4 = 2,0 gam |
0,25 0,25 |
|
|
c) Tính khối lượng dung dịch axit HCl 7,3% đã dùng: mMgO = 0,05 mol - Theo (1), (2): nHCl = (0,1+0,05).2 = 0,3 mol.
|
0,25
0,25
|