Chuẩn độ axit bazơ được sử dụng rất rộng rãi để xác định nồng độ các dung dịch axit hoặc các dung dịch bazơ
Chuẩn độ axit bazơ được sử dụng rất rộng rãi để xác định nồng độ các dung dịch axit hoặc các dung dịch bazơ. Trong phương pháp chuẩn độ axit – bazơ người ta dùng dung dịch kiềm (NaOH hoặc KOH) đã biết chính xác nồng độ làm dung dịch chuẩn để chuẩn độ dung dịch axit hoặc dùng dung dịch axit mạnh(HCl, H2SO4, HNO3) đã biết chính xác nồng độ để chuẩn độ dung dịch bazơ. Trong quá trình chuẩn độ, pH của dung dịch thay đổi liên tục theo lượng dung dịch chuẩn thêm vào.
Tại điểm tương đương (là thời điểm mà dung dịch chuẩn vừa trung hòa hết dung dịch axit hoặc bazơ cần chuẩn độ) giá trị pH của dung dịch phụ thuộc vào bản chất của axit hoặc bazơ cần chuẩn độ và nồng độ của chúng. Để nhận ra điểm tương đương của phản ứng chuẩn độ, người ta dùng chất chỉ thị gọi là chất chỉ thị axit - bazơ hay chất chỉ thị pH (màu của chất chỉ thị phụ thuộc vào pH của dung dịch). Với mỗi phản ứng chuẩn độ axit - bazơ người ta chọn chất chỉ thị có khoảng pH đổi màu nằm trong bước nhảy pH (sự thay đổi pH của dung dịch một cách đột ngột xung quanh điểm tương đương). Có thể xác định bước nhảy pH dựa vào việc xác định pH của dung dịch ở thời điểm gần sát (sai số cho phép là ±0,1%) điểm tương đương.
Thí nghiệm: Một sinh viên tiến hành thí nghiệm chuẩn độ như sau:
- Lấy 100 ml dung dịch HCl 0,1 M vào bình tam giác thủy tinh.
- Lấy dung dịch chuẩn NaOH 0,1 M vào buret.
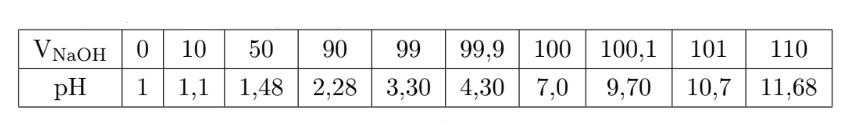
- Mở van khóa của buret để thêm từ từ dung dịch chuẩn NaOH vào bình tam giác thủy tinh. Sinh viên ghi lại quá trình làm thí nghiệm và tính được pH của dung dịch trong quá trình chuẩn độ, kết quả được ghi trong bảng sau:
Câu 1. Phương trình phản ứng trung hòa xảy ra trong thí nghiệm trên là
A. 2NaCl + 2H2O điện phân → 2NaOH + Cl2 + H2
B. 2HCl + Na2O → 2NaCl + H2O.
C. 2HCl + 2Na → 2NaCl + H2.
D. HCl + NaOH → NaCl + H2O.
Giải thích:
Phương trình phản ứng trung hòa xảy ra trong thí nghiệm: HCl + NaOH → NaCl + H2O
Câu 2. Nếu sinh viên sử dụng chất chỉ thị là phenolphtalein thì hiện tượng quan sát được trong bình tam giác thủy tinh tại thời điểm thêm 110 ml dung dịch NaOH là
A. Dung dịch trong bình tam giác thủy tinh có màu hồng.
B. Dung dịch trong bình tam giác thủy tinh có màu xanh.
C. Dung dịch trong bình tam giác thủy tinh có màu đen.
D. Dung dịch trong bình tam giác thủy tinh sủi bọt khí.
Giải thích:
Theo bảng số liệu được ghi lại trong thí nghiệm, tại thời điểm thêm 110 ml dung dịch NaOH, dung dịch trong bình tam giác thủy tinh có pH = 11,68 ⇒ Môi trường kiềm ⇒ Dung dịch trong bình tam giác thủy tinh có màu hồng.
Câu 3. Tại thời điểm thêm 40 ml dung dịch NaOH vào bình tam giác thủy tinh, pH của dung dịch có giá trị là
A. 1,56.
B. 1,37.
C. 1,63.
D. 1,15.
Giải thích:
Câu 4. Điểm tương đương của quá trình chuẩn độ đạt được tại thời điểm thể tích dung dịch NaOH thêm vào
A. 90 ml.
B. 100 ml.
C. 110 ml.
D. 10 ml.
Giải thích:
Điểm tương đương là thời điểm mà dung dịch chuẩn NaOH vừa trung hòa hết dung dịch axit HCl. nHCl = 0,1.0,1 = 0,01mol.
HCl + NaOH → NaCl + H2O
0, 01 → 0, 01 mol
⇒ VNaOH = 0,01/ 0,1 = 0,1 lít = 100 ml.
Câu 5. Đồ thị biểu diễn sự biến thiên pH của dung dịch trong quá trình chuẩn độ ở thí nghiệm trên là (đường biểu diễn trên đồ thị đó gọi là đường định phân)
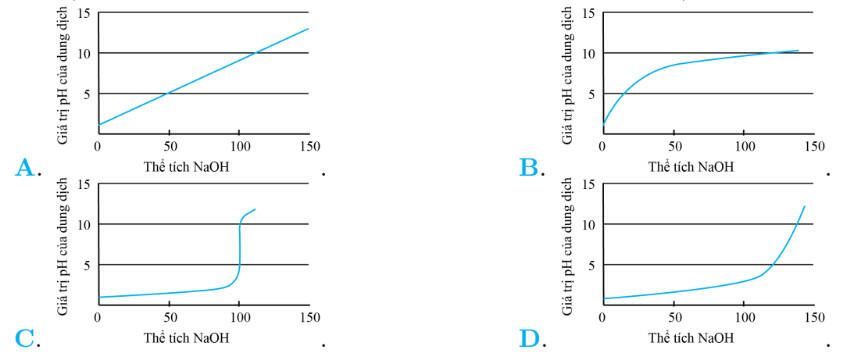
Đáp án: C
Giải thích:
Để vẽ được đồ thị biểu diễn sự biến thiên pH của dung dịch trong quá trình chuẩn độ ở thí nghiệm, dựa vào bảng kết quả đã ghi ở thí nghiệm để vẽ đồ thị, ở trục hoành của đồ thị có thể ghi khối lượng dung dịch NaOH, trong đó ghi giá trị pH của dung dịch. Để vẽ đường phân cách, chúng ta cần tìm các điểm trên đường thẳng để nối chúng lại với nhau.
Để tìm điểm trên đường định phân, trên trục hoành tại điểm có giá trị VNaOH = 10 ml kẻ đường thẳng a song song với trục tung, trên trục tung tại điểm có giá trị pH = 1,1 kẻ đường b song song với trục hoành thì giao điểm của hai đường thẳng a và b chính xác là một điểm trên đường thẳng, các điểm còn lại trên đường thẳng tìm tương tự. Khi đó đồ thị biểu diễn sự biến thiên pH của dung dịch trong quá trình chuẩn độ ở thí nghiệm trên có dạng như hình C.
Câu 6. Bảng sau đây ghi khoảng pH đổi màu của 3 chất chỉ thị thường được sử dụng nhiều trong chuẩn độ axit – bazơ
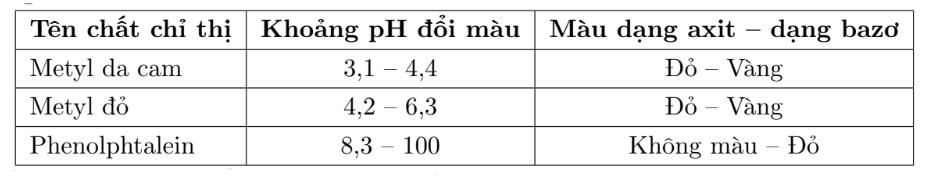
Chất chỉ thị nào có thể sử dụng cho quá trình chuẩn độ ở thí nghiệm trên?
A. Chỉ sử dụng được metyl da cam.
B. Chỉ sử dụng được metyl đỏ.
C. Chỉ sử dụng được phenolphtalein.
D. Có thể sử dụng một trong các chất chỉ thị: metyl da cam, metyl đỏ, phenolphtalein.
Giải thích:
Xung quanh điểm tương đương (thời điểm thêm 100 ml NaOH) có sự thay đổi pH rất đột ngột: Khi thêm 99,9 ml NaOH vào tức là khi đã chuẩn độ 99,9% lượng axit thì pH của dung dịch bằng 4,3. Khi thêm vào 100,1 ml NaOH vào tức là khi đã chuẩn độ quá 0,1% thì pH của dung dịch bằng 9,7 (tức là bước nhảy pH là từ 4,3 đến 9,7). Nếu ta chọn các chất chỉ thị nào có khoảng đổi màu nằm trong khoảng từ 4,3 đến 9,7 để kết thúc chuẩn độ thì sai số không vượt quá 0,1%. Ta thấy trong trường hợp này có thể dùng một trong 3 chất chỉ thị metyl da cam, metyl đỏ và phenolphtalein làm chất chỉ thị.
