So sánh nhiệt độ sôi và khả năng hòa tan trong nước giữa NH3 và CH4
Sự sôi xảy ra khi chất lỏng được đun nóng đến mức áp suất hơi của nó bằng với áp suất bên ngoài, dẫn đến sự thay đổi vật lý và chuyển đổi nhanh chóng thành hơi. Trong khi đó, độ hòa tan chỉ đơn giản là khả năng của một chất rắn, lỏng hoặc khí tan chảy vào dung môi, tạo thành một dung dịch đồng nhất.
1. Các yếu tố ảnh hưởng đến nhiệt độ sôi và khả năng hòa tan trong nước của các chất
a. Ảnh hưởng đến nhiệt độ sôi
- Ảnh hưởng bởi các chất liên kết ion
Với các chất liên kết ion, thường có nhiệt độ sôi lớn hơn so với các chất cộng hóa trị. Liên kết ion càng lớn thì nhiệt độ sôi càng cao.
- Ảnh hưởng bởi các chất liên kết cộng hóa trị
Các chất cộng hóa trị có nhiệt độ sôi khác nhau do ảnh hưởng của liên kết hidro, hình dạng phân tử và khối lượng phân tử. Liên kết hidro càng lớn thì nhiệt độ sôi càng cao. Thứ tự sắp xếp lực liên kết hidro giữa các nhóm chức là: phenol< ete< andehit< este< ancol< axit (-CO-< -CHO< -OH<- COOH).
- Ảnh hưởng bởi khối lượng và hình dạng phân tử của chất
Khối lượng phân tử càng lớn thì độ sôi càng cao, và phân tử mạch không phân nhánh sẽ có nhiệt độ sôi cao hơn so với phân tử phân nhánh. Ngoài ra, sức căng mặt ngoài của phân tử càng co tròn thì sức căng mặt ngoài càng thấp và phân tử càng dễ bứt ra khỏi bề mặt chất lỏng, dẫn đến độ sôi càng thấp.
b. Ảnh hưởng đến khả năng hòa tan
- Nhiệt độ: Độ tan của chất khí giảm khi nhiệt độ tăng. Độ tan của chất rắn có thể tăng hoặc giảm tùy thuộc vào việc chất rắn có thu nhiệt hay tỏa nhiệt khi hòa tan.
- Áp suất: Lượng chất khí hoà tan trong dung môi tăng tỉ lệ thuận với áp suất của chất khí. Điều luật Henry chỉ đúng cho các chất khí có độ tan nhỏ.
- Độ phân cực: Các chất phân cực dễ tan trong dung môi phân cực và ngược lại.
- Dạng thù hình: Độ tan của dạng vô định hình lớn hơn so với dạng tinh thể.
- Hiện tượng hydrat hóa: Độ tan của dạng khan lớn hơn so với dạng ngâm nước.
- Đa hình: Cùng một chất rắn có thể kết tinh dưới nhiều dạng tinh thể khác nhau, mỗi dạng tinh thể có các đặc tính khác nhau.
2. So sánh nhiệt độ sôi và khả năng hòa tan trong nước giữa NH3 và CH4
Công thức Lewis của NH3:
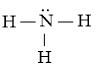
Công thức Lewis của CH4:
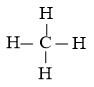
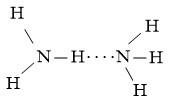
- Nhiệt độ sôi: Sự khác biệt về độ phân cực giữa liên kết N-H trong phân tử NH3 và liên kết C-H trong phân tử CH4 là nguyên nhân khiến cho phân tử NH3 có khả năng tạo liên kết hydrogen liên phân tử giữa các phân tử NH3 với nhau, trong khi đó phân tử CH4 không có khả năng này. Do độ âm điện của nguyên tử N trong phân tử NH3 cao hơn so với nguyên tử C trong phân tử CH4, nên liên kết N-H trong phân tử NH3 phân cực mạnh hơn liên kết C-H trong phân tử CH4. Ngoài ra, nguyên tử N trong phân tử NH3 còn một cặp electron chưa liên kết, tạo điều kiện cho việc tạo liên kết hydrogen giữa các phân tử NH3. Do đó, nhiệt độ sôi của phân tử NH3 cao hơn nhiệt độ sôi của phân tử CH4.
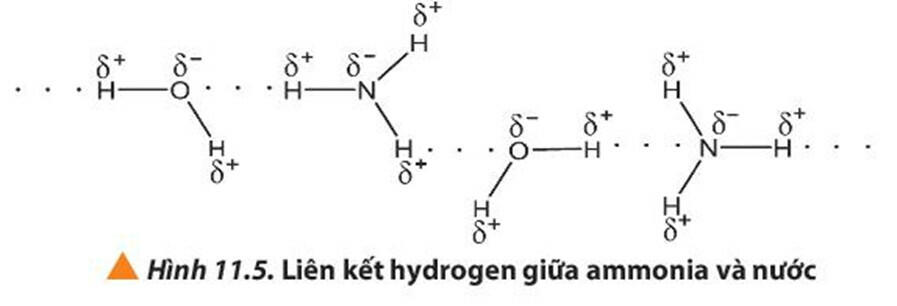
- Khả năng hòa tan trong nước: Phân tử NH3 có thể tạo liên kết hydrogen với nước còn CH4 thì không. Do đó NH3 tan tốt trong nước hơn CH4.
--------------------------------
Trên đây Toploigiai đã cùng các bạn So sánh nhiệt độ sôi và khả năng hòa tan trong nước giữa NH3 và CH4. Chúng tôi hi vọng các bạn đã có kiến thức hữu ích khi đọc bài viết này, chúc các bạn học tốt.
