Lý thuyết Hóa 10 Bài 32. Hiđro sunfua, lưu huỳnh đioxit, lưu huỳnh trioxit
Lý thuyết Hóa 10 Bài 32. Hiđro sunfua, lưu huỳnh đioxit, lưu huỳnh trioxit
A – HIĐRO SUNFUA (H2S)
I. TÍNH CHẤT VẬT LÍ
- Chất khí, không màu, có mùi trứng thối đặc trưng, rất độc.
- Nặng hơn không khí ![]()
- Hóa lỏng ở −600C, tan ít trong nước.
II. TÍNH CHẤT HÓA HỌC
1. Tính axit yếu
- Hiđro sunfua tan trong nước tạo thành dung dịch axit sunfuhiđric có tính axit rất yếu (yếu hơn axit cacbonic).
- Axit sunfuhiđric tác dụng với dung dịch bazơ có thể tạo ra 2 loại muối:
+ Muối trung hòa: Na2S ; CaS ; FeS …
+ Muối axit: NaHS , Ba(HS)2 ...
Ví dụ:
H2S + NaOH ⟶ NaHS + H2O
H2S + 2NaOH ⟶ Na2S + 2H2O
2. Tính khử mạnh
- Nguyên tố S trong H2S có số oxi hóa thấp nhất (−2). Tùy điều kiện phản ứng mà số oxi hóa của S thay đổi:
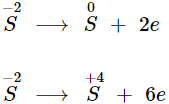
⟹ H2S có tính khử mạnh.
- Ví dụ:
* Trong điều kiện thường, dung dịch H2S tiếp xúc với oxi của không khí, dần trở nên vẩn đục màu vàng:
![]()
* Ở nhiệt độ cao, khí H2S cháy trong không khí cho ngọn lửa màu xanh nhạt:
![]()
* Ví dụ khác:
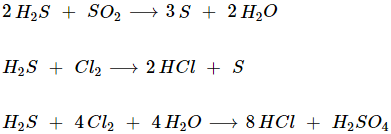
III.TRẠNG THÁI TỰ NHIÊN VÀ ĐIỀU CHẾ
- Trong tự nhiên, H2S có trong một số nước suối, trong khí núi lửa, bốc ra từ xác động vật…
- Điều chế: Trong công nghiệp, người ta không sản xuất khí H2S. Trong phòng thí nghiệm, khí H2S được điều chế bằng phản ứng hóa học của dung dịch axit clohiđric với sắt (II) sunfua.
![]()
B – LƯU HUỲNH ĐIOXIT SO2
I. TÍNH CHẤT VẬT LÍ
- Khí không màu, mùi hắc, rất độc.
- Nặng hơn không khí ![]() hóa lỏng ở −100C và tan nhiều trong nước.
hóa lỏng ở −100C và tan nhiều trong nước.
II. TÍNH CHẤT HÓA HỌC
1. Lưu huỳnh đioxit là oxit axit
* SO2 tan trong nước tạo axit tương ứng:
![]() (axit sunfuarơ: tính axit yếu)
(axit sunfuarơ: tính axit yếu)
- Tính axit: H2S < H2SO3 < H2CO3
- Không bền, dễ phân hủy tạo SO2
* SO2 tác dụng với dung dịch bazơ có thể tạo 2 loại muối:
- Muối trung hòa: Na2SO3 , CaSO3...
- Muối axit: NaHSO3 , Ba(HSO3)2 ...
SO2 + NaOH ⟶ NaHSO3
SO2 + 2NaOH ⟶ Na2SO3 + H2O
2. Lưu huỳnh đioxit là chất khử và là chất oxi hóa
- Nguyên tố S trong SO2 có số oxi hóa trung gian +4:
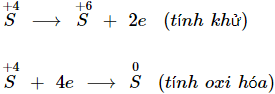
⟹ SO2 vừa có tính khử vừa có tính oxi hóa.
a) Lưu huỳnh đioxit là chất khử
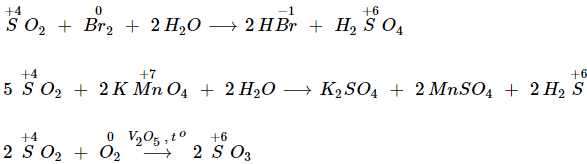
b) Lưu huỳnh đioxit là chất oxi hóa
![]()
III. ỨNG DỤNG VÀ ĐIỀU CHẾ LƯU HUỲNH ĐIOXIT
1. Ứng dụng
- Lưu huỳnh đioxit dùng để sản xuất H2SO4 trong công nghiệp, làm chất tẩy trắng giấy và bột giấy, chất chống nấm mốc lương thực và thực phẩm…
2. Điều chế lưu huỳnh đioxit
- Trong phòng thí nghiệm, SO2 được điều chế bằng cách đun nóng dung dịch H2SO4 với muối Na2SO3.
Na2SO3 + H2SO4 ⟶ Na2SO4 + H2O + SO2
- Trong công nghiệp, SO2 được sản xuất bằng cách đốt S hoặc quặng pirit sắt.
![]()
Hay:
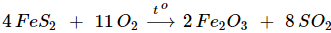
C – LƯU HUỲNH TRIOXIT SO3
I. TÍNH CHẤT
- Chất lỏng không màu, nóng chảy ở 170C, tan vô hạn trong nước và trong axit sunfuric.
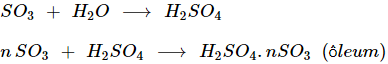
- SO3 có đầy đủ tính chất của oxit axit, tác dụng với dung dịch bazơ và oxit bazơ tạo muối sunfat.
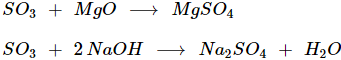
II. ỨNG DỤNG VÀ SẢN XUẤT
- SO3 dùng làm sản phẩm trung gian để sản xuất H2SO4.
- Trong công nghiệp, SO3 được sản xuất bằng cách oxi hóa lưu huỳnh đioxit.
![]()
Xem thêm Giải Hóa 10: Bài 32. Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit
