Lý thuyết Hóa 10 Bài 26. Luyện tập: Nhóm halogen
Lý thuyết Hóa 10 Bài 26. Luyện tập: Nhóm halogen
I. CẤU TẠO NGUYÊN TỬ, PHÂN TỬ VÀ CÁCH ĐIỀU CHẾ CÁC HALOGEN
- Từ F2 đến I2 bán kính nguyên tử tăng dần, độ âm điện giảm dần, tính oxi hóa giảm dần.
- Lớp ngoài cùng có 7e.
- Phân tử gồm 2 nguyên tử, có liên kết cộng hóa trị không cực.
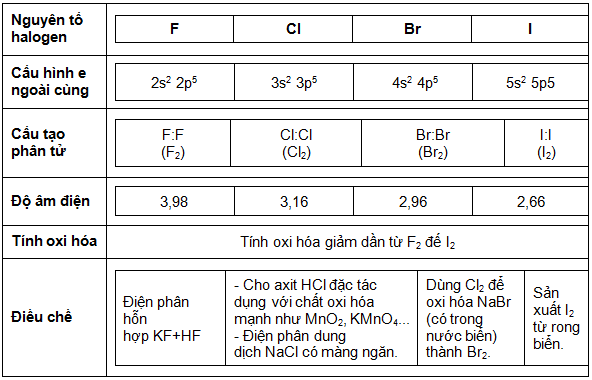
II. TÍNH CHẤT HÓA HỌC
|
Halogen |
F2 |
Cl2 |
Br2 |
I2 |
|
Tác dụng với kim loại |
Oxi hóa được tất cả các kim loại tạo ra muối florua. |
Oxi hóa được hầu hết các kim loại tạo ra muối clorua, phản ứng cần đun nóng. |
Oxi hóa được nhiều kim loại tạo ra muối bromua, phản ứng cần đun nóng. |
Oxi hóa được nhiều kim loại tạo ra muối iotua, phản ứng chỉ xảy ra khi đun nóng hoặc có chất xúc tác. |
|
Tác dụng với khí hiđro |
Phản ứng xảy ra ngay trong bóng tối, ở nhiệt độ rất thấp và nổ mạnh. |
Cần chiếu sáng, phản ứng nổ. |
Cần đun nóng. |
Cần đun nóng ở nhiệt độ cao. |
|
Tác dụng với nước |
Phân hủy mãnh liệt ngay ở nhiệt độ thường. |
Ở nhiệt độ thường, phản ứng thuận nghịch. |
Ở nhiệt độ thường, phản ứng thuận nghịch, chậm hơn Clo. |
Hầu như không tác dụng. |
* Lưu ý
- Axit halogen hiđric: axit HF là axit yếu, các axit HCl, HBr, HI là các axit mạnh.
⟶ Tính axit tăng từ HF đến HI.
- Clorua vôi, nước gia-ven, kali clorat là những chất oxi hóa mạnh có tính tẩy màu và sát trùng.
III. PHÂN BIỆT CÁC ION F−, Cl−, Br−, I−
* Dùng AgNO3 làm thuốc thử:
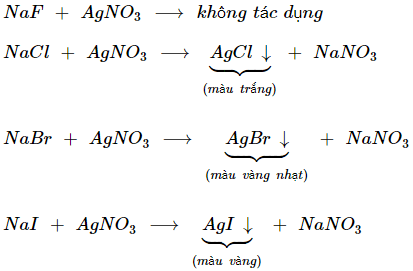
⟹ Kết luận:
- Các muối chứa gốc F− không phản ứng.
- Các muối chứa gốc Cl− tạo kết tủa trắng.
- Các muối chứa gốc Br− tạo kết tủa vàng nhạt.
- Các muối chứa gốc I− tạo kết tủa vàng đậm.
