Bài 26. Clo
Bài 26. Clo
Bài 26.1 trang 31 SBT Hóa học 9
Trong các phản ứng hoá học, clo
A. Chỉ thể hiện tính khử.
B. Chỉ thể hiện tính oxi hoá
C. Không thể hiện tính oxi hoá.
D. Thể hiện tính oxi hoá và tính khử.
Lời giải
Đáp án D.
Bài 26.2 trang 31 SBT Hóa học 9
Trong phòng thí nghiệm, khí clo thường được điều chế bằng cách oxi hoá chất nào sau đây?
A. NaCl;
B. KMnO4;
C. KClO3;
D. HCl.
Lời giải
Đáp án D.
Bài 26.3 trang 31 SBT Hóa học 9
Người ta căn cứ vào tính chất hóa học nào để đánh giá clo là phi kim hoạt động hoá học mạnh? Cho thí dụ minh họa.
Lời giải
Bài 26.3 trang 31 SBT Hóa học 9
Người ta căn cứ vào tính chất hóa học nào để đánh giá clo là phi kim hoạt động hoá học mạnh? Cho thí dụ minh họa.
Lời giải
- Clo tác dụng với hầu hết các kim loại. Thí dụ: 2Fe + 3Cl2 → 2FeCl3.
- Clo tác dụng với hiđro (khi chiếu sáng hoặc đốt nóng) tạo thành hiđro elorua.
Bài 26.4 trang 31 SBT Hóa học 9
Viết các phương trình hoá học của các phản ứng sau (ghi rõ điều kiện, nếu có).
KClO3 to→ A + B
A + H20 → D + E + F
D + E → KCl + KClO + H20
Lời giải
2KClO3 to→ 2KCl + 3O2
2KCl + 2H2O → 2KOH + H2 + Cl2
Cl2 + 2KOH → KCl + KClO + H2O
Bài 26.5 trang 31 SBT Hóa học 9
Hình vẽ 3.1 mô tả phản ứng của khí hiđro cháy trong khí clo. Em hãy cho biết giấy quỳ tím ẩm có đổi màu không?
Tại sao?
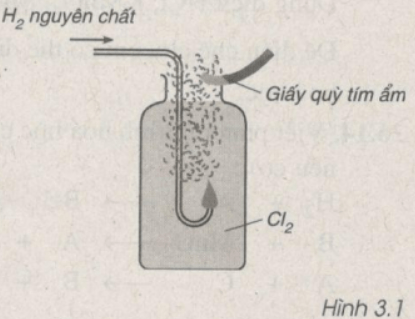
Lời giải
Giấy quỳ tím ẩm chuyển sang màu đỏ vì
Cl2 + H2 → 2HCl
Khí HCl gặp nước thành dung dịch axit nên làm quỳ tím ẩm chuyển sang màu đỏ.
Bài 26.6 trang 32 SBT Hóa học 9
Có 4 cốc đựng 4 chất lỏng sau: H20, dung dịch NaCl, dung dịch HCl, dung dịch Na2CO3. Không dùng hoá chất nào khác, hãy nhận biết từng chất (được dùng phương pháp vật lí).
Lời giải
- Lấy mỗi dung dịch một ít, sau đó đổ vào nhau từng cặp một, cặp nào thấy bọt khí nổi lên thì cặp đó là HCl và Na2CO3, còn cặp kia là H2O và NaCl.
2HCl + Na2CO3 → 2NaCl + H20 + CO2
- Như vậy có hai nhóm: nhóm 1 gồm H2O và dung dịch NaCl, nhóm 2 gồm dung dịch Na2CO3 và dung dịch HCl.
- Đun đến cạn 2 cốc nhóm 1: cốc không có cặn là H2O, cốc có cặn là muối NaCl.
- Đun đến cạn 2 cốc nhóm 2: cốc không có cặn là HCl, cốc có cặn là muối Na2CO3.
Bài 26.7 trang 32 SBT Hóa học 9
Hợp chất nào sau đây phản ứng được với clo?
A. NaCl;
B. NaOH;
C. CaCO3;
D. HCl.
Lời giải
Đáp án B.
Cl2 + 2NaOH → NaCl + NaClO + H20
Bài 26.8 trang 32 SBT Hóa học 9
Cho một luồng khí clo dư tác dụng với 9,2 gam kim loại sinh ra 23,4 gam muối của kim loại có hoá trị I. Hãy xác định tên của kim loại.
Lời giải
- Gọi kí hiệu và nguyên tử khối của kim loại là M.
Phương trình hoá học:
2M + Cl2 → 2MCl
9,2 x 2(M + 35,5) = 2M x 23,4
653,2 = 28,4M
M = 23. Vậy kim loại M là kim loại natri (Na).
Bài 26.9 trang 32 SBT Hóa học 9
Cho 5,6 gam bột sắt vào bình khí clo có dư. Sau phản ứng thu được 16,25 gam muối sắt. Tính khối lượng khí clo đã tham gia phản ứng.
Lời giải
Phương trình hoá học: 2Fe + 3Cl2 to→ FeCl3
Theo định luật bảo toàn khối lượng:
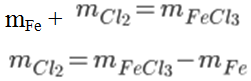
= 16,25 - 5,6 = 10,65g
Bài 26.10 trang 32 SBT Hóa học 9
Cho 12,7 gam muối sắt clorua vào dung dịch NaOH có dư trong bình kín, thu được 9 gam một chất kết tủa. Công thức hoá học của muối là
A. FeCl3;
B. FeCl2;
C. FeCl;
D. FeCl4
Lời giải
Đáp án B.
Gọi công thức của muối là FeClx(x là hóa trị của kim loại Fe).
Phương trình hóa học:
FeClx + xNaOH → Fe(OH)x + xNaCl
(56+35,5x)gam (56+17x)gam
12,7 gam 9 gam
Ta có tỷ lệ:
(56+35,5x)/12,7 = (56+17x)/9 => x = 2 → Công thức của muối là FeCl2
Bài 26.11 trang 32 SBT Hóa học 9
Viết các phương trình hoá học của các phản ứng sau (ghi rõ điều kiện phản ứng, nếu có):
Cl2 + A → B
B + Fe → C + H2
C + E → F + NaCl
F + B → C + H2O
Lời giải
Cl2 + H2 → 2HCl
2HCl + Fe → FeCl2 + H2
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
Fe(OH)2 + HCl → FeCl2 + 2HCl
Bài 26.12 trang 32 SBT Hóa học 9
Qua hình vẽ 3.2, em hãy cho biết mức độ phản ứng giữa clo và hiđro.
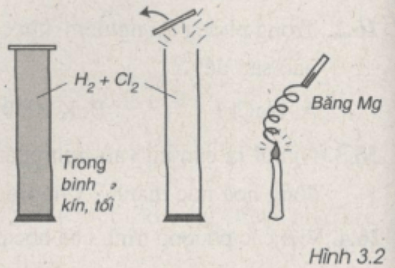
Lời giải
Qua hình vẽ ta nhận thấy khi có ánh sáng (băng Mg cháy), Cl2 phản ứng rất mạnh với H2 nên nắp bình bị bật ra.
Bài 26.13 trang 32 SBT Hóa học 9
Trong phòng thí nghiệm có các hoá chất sau:
Dung dịch HCl, KMnO4, MnO2, NaCl, H20.
Để điều chế clo, em có thể dùng những hoá chất nào? Viết các phương trình hoá học.
Lời giải
4HCl + MnO2 → H2 + 2H2O + MnH2
16HCl + 2KMnO4 → 5H2 + 2MnH2 + 2KCl + 8H2O
2NaCl + 2H2O → 2NaOH + H2 + H2
Bài 26.14 trang 32 SBT Hóa học 9
Viết phương trình hoá học của các phản ứng sau (ghi rõ điều kiện phản ứng, nếu có):
H2 + A → B
B + MnO2 → A + C + D
A + C → B + E
Lời giải
H2 + Cl2 → 2HCl
4HCl + MnO2 → Cl2 + 2H2O + MnCl2
Cl2 + H2O → HCl + HClO
Bài 26.15 trang 33 SBT Hóa học 9
a) Viết các phương trình hoá học thực hiện những chuyển đổi hoá học sau:
![]()
b) Nêu cách tách khí Cl2 ra khỏi hỗn hợp: Cl2 có lẫn N2 và H2.
Lời giải
a)
(1) MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
(2) 2Fe + 3Cl2 → 2FeCl3
(3) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
(4) 2NaCl + 2H2O → 2NaOH + H2 + Cl2
(5) Cl2 + Cu → CuCl2
(6) CuCl2 + 2AgNO3 → 2AgCl + CuCO3
b) Dần khí H2 dư vào hỗn hợp, rồi đưa ra ánh sáng, sau một thời gian cho hỗn hợp khí qua nước, ta được dung dịch HCl (N2 không tác dụng với H2 ở điều kiện thường). Cho dung dịch HCl tác dụng với MnO2 thu được khí Cl2.
Bài 26.16 trang 33 SBT Hóa học 9
Có các chất: KMnO4, MnO2, HCl.
a) Nếu khối lượng các chất KMnO4 và MnO2 bằng nhau, chọn chất nào để điều chế được nhiều clo hơn?
b) Nếu số mol KMnO4 và MnO2 bằng nhau, chọn chất nào để điều chế được nhiều clo hơn?
Lời giải
a)
4HCl + MnO2 → MnCl2 + 2H2O + Cl2
1 mol MnO2 → 1 mol Cl2
a/87 mol MnO2 → a/87 mol Cl2
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 8H2O + 5Cl2
2 mol KMnO4 → 5 mol Cl2
a/158 mol KMnO4 → a/63,2 mol
Có a/63,2 > a/87
Chọn KMnO4 đều chế được nhiều clo hơn
b)
4HCl + MnO2 → MnCl2 + 2H2O + Cl2
a mol MnO2 → a mol Cl2
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 8H2O + 5Cl2
2 mol KMnO4 → 5 mol Cl2
a mol KMnO4 → 5a/2 mol
Chọn KMnO4 đều chế được nhiều clo hơn.

