Bài 15. Định luật bảo toàn khối lượng
Giải SBT Hóa 8: Bài 15. Định luật bảo toàn khối lượng
Bài 15.1 trang 20 sách bài tập Hóa 8:
a) Viết công thức về khối lượng cho phản ứng giữa kim loại kẽm và axit HCl tạo ra chất kẽm clorua ZnCl2 và khí hidro. (xem lại hình 2.6, trong SGK về phản ứng này).
b) Cho biết khối lượng của kẽm và axit clohidric đã phản ứng là 6,5g và 7,3g, khối lượng của chất kẽm clorua là 13,6g.
Hãy tính khối lượng của khí hidro bay lên.
Lời giải:
a) mZn + mHCl = mZnCl2 + mH2
b) mH2 = (mZn + mHCl) - mZnCl2
= (6,5 + 7,3) – 13,6 = 0,2(g)
Bài 15.2 trang 20 sách bài tập Hóa 8:
Biết rằng axit clohidric có phản ứng với chất canxi cacbonat tạo ra chất canxi clorua, nước và khí cacbon dioxit thoát ra. Một cốc dựng dung dịch axit clohidric (1) và cục đá (2) (thành phần chính là chất canxi cacbonat) được đặt trên một đĩa cân. Trên đĩa cân thứ hai đặt quả cân (3) vừa đủ cho cân ở vị trí cân bằng.
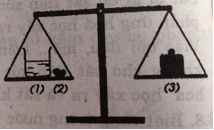
Bỏ cục đá vôi vào dung dịch axit clohidric. Sau một thời gian phản ứng, cân ở vị trí nào: A, B hay C? Giải thích.
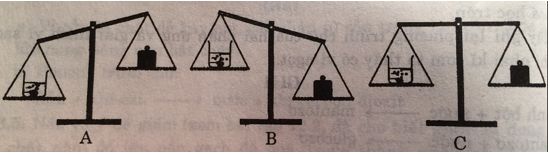
Lời giải:
Chọn B. Vì trong phản ứng có một lượng khí cacbon dioxit thoát ra ngoài nên khối lượng sẽ giảm đi.
Bài 15.3 trang 20 sách bài tập Hóa 8:
Hãy giải thích vì sao?
a) Khi nung nóng cục đá vôi thì thấy khối lượng giảm đi? (Xem lại bài tập 12.3 về đá vôi trong lò nung vôi)
b) Khi nung nóng miếng đồng trong không khí (có khí oxi) thì thấy khối lượng tăng lên? (Xem bài tập 3, thuộc Bài 15, SGK; khi đun nóng kim loại đồng (Cu) cũng có phản ứng tương tự kim loại magie (Mg).
Lời giải:
a) Khi nung đá vôi thì có khí cacbon đioxit thoát ra nên khối lượng giảm đi.
b) Vì khi đun nóng miếng đồng trong không khí thì đồng hóa hớp với oxi tạo ra chất mới nên khối lượng tăng.
Bài 15.4 trang 20 sách bài tập Hóa 8:
Đun nóng mạnh hỗn hợp gồm 28g bột sắt và 20g bột lưu huỳnh thu được 44g chất sắt (II) sunfua (FeS) màu xám.
Biết rằng, để cho phản ứng hóa hợp xảy ra hết người ta đã lấy dư lưu huỳnh. Tính khối lượng lưu huỳnh lấy dư.
Lời giải:
Theo định luật bảo toàn khối lượng, ta có công thức khối lượng của phản ứng:
mFe + mS = mFeS
Khối lượng lưu huỳnh đã hóa hợp với sắt là:
mS = mFeS – mFe = 44 – 28 = 16(g)
Khối lượng lưu huỳnh lấy dư: 20 – 16 = 4 (g)
Bài 15.5* trang 21 sách bài tập Hóa 8:
Biết rằng canxi oxit (vôi sống) CaO hóa hợp với nước tạo ra canxi hidroxit (vôi tôi) Ca(OH)2, chất này tan được trong nước, cứ 56g CaO hóa hợp vừa đủ với 18g H2O. Bỏ 2,8g CaO vào trong một cốc lớn chứa 400ml nước tạo ra dung dịch Ca(OH)2, còn gọi là nước vôi trong.
a) Tính khối lượng của canxi hidroxit.
b) Tính khối lượng của dung dịch Ca(OH)2, giả sử nước trong cốc là nước tinh khiết.
Lời giải:
a) Ta có:
Cứ 56g CaO hóa hợp vừa đủ với 18g H2O.
Vậy 2,8g CaO hóa hợp vừa đủ với x(g) H2O.
→ x = (2,8 x 18)/56 = 0,9(g)
Công thức khối lượng của phản ứng:
mCaO + mH2O = mCa(OH)2
2,8 + 0,9 = 3,7 (g)
Vậy khối lượng của Ca(OH)2 là 3,7g.
b) Vì nước tinh khiết có D = 1g/ml → mH2O = 400g.
Vậy khối lượng của dd Ca(OH)2: 2,8 + 400 = 402,8g.
Bài 15.6* trang 21 sách bài tập Hóa 8:
Đung nóng 15,8g kali pemanganat(thuốc tím) KMnO4trong ống nghiệm để điều chế khí oxi. Biết rằng, chất rắn còn lại trong ống nghiệm có khối lượng 12,6g; khối lượng khí oxi thu được là 2,8g. Tính hiệu suất của phản ứng phân hủy.
Lời giải:
Theo định luật bảo toàn khối lượng ta có: mO2 = 15,8 – 12,6 = 3,2(g)
Hiệu suất của phản ứng phân hủy: H = 2,8/3,2 x 100 = 87,5%
Bài 15.7* trang 21 sách bài tập Hóa 8:
Còn có thể điều chế khí oxi bằng cách nung nóng kali clorat KClO3 (chất rắn màu trắng). Khi đun nóng 24,5g KClO3, chất rắn còn lại trong ống nghiệm có khối lượng là 13,45g. Tính khối lượng khí oxi thu được, biết hiệu suất của phản ứng phân hủy là 80%.
Lời giải:
Theo định luật bảo toàn khối lượng, ta có khối lượng khí oxi thu được là:
mO2 = 24,5 – 13,45 = 11,05(g)
Khối lượng thực tế oxi thu được: mO2 = (11,05 x 80)/100 = 8,84 (g)
