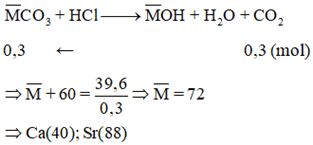Bài 11. Luyện tập: Bảng tuần hoàn, sự biến đổi tuần hoàn cấu hình electron nguyên tử và tính chất của các nguyên tố hóa học
Bài 11: Luyện tập: Bảng tuần hoàn, sự biến đổi tuần hoàn cấu hình electron nguyên tử và tính chất của các nguyên tố hóa học
Bài 11.1 trang 26 Sách bài tập Hóa học 10
Trong các nguyên tố sau, nguyên tử của nguyên tố có bán kính lớn nhất là
A. O
B. F
C. N
D. Al.
Lời giải:
Đáp án D
Bài 11.2 trang 26 Sách bài tập Hóa học 10
Cho các nguyên tố : Ca, C, F, O, Be.
a) Dãy nguyên tố sắp xếp theo chiều tăng dần độ âm điện của nguyên tử là
A. C, F, Ca, O, Be.
B. Ca, Be, C, O, F.
C. F, O, C, Be, Ca.
D. O, C, F, Ca, Be.
b) Dãy nguyên tố sắp xếp theo chiều tăng dần của bán kính nguyên tử là
A. C, F, O, Be, Ca.
B. Ca, Be, C, O, F.
C. F, C, O, Ca, Be.
D. F, O, C, Be, Ca.
Lời giải:
a) Đáp án B
b) Đáp án D
Bài 11.3 trang 26 Sách bài tập Hóa học 10
Khối lượng của nguyên tử beri (9,0124Be) bằng 9,012u.
a) Nguyên tử khối của beri bằng
A. 9.
B. 9,012.
C. 9,012 g/mol.
D 4.
b) Số khối hạt nhân nguyên tử beri bằng
A. 9.
B. 9,012.
C. 9,012 g/mol.
D. 4.
c) Khối lượng mol nguyên tử beri bằng
A. 9.
B. 9,012.
C. 9,012 g/mol;
D 4.
Lời giải:
a) Nguyên tử khối của beri là 9,012 ( đáp án B)
b) số khối hạt nhân nguyên tử beri: 9 ( đáp án A)
c) khối lượng mol nguyên tử: 9,012 g/mol (đáp án C)
Bài 11.4 trang 27 Sách bài tập Hóa học 10
Khi cho hạt nhân 42He bắn phá vào hạt nhân 126C, người ta thu được một nơtron và một hạt nhân Y. Y là hạt nhân nào cho dưới đây ?

Lời giải:
Đáp án A
Bài 11.5 trang 27 Sách bài tập Hóa học 10
Các nguyên tố thuộc cùng một nhóm A thì
A. ở vỏ electron của nguyên tử các nguyên tố nhóm A đó có số electron như nhau.
B. có số lớp electron như nhau.
C. có số e ngoài cùng như nhau.
D. có cùng số electron s hay p.
Lời giải:
Đáp án C
Bài 11.6 trang 27 Sách bài tập Hóa học 10
Nguyên tử của nguyên tố X là [Ar]3d54s2 Vị trí của X trong bảng tuần hoàn là
A. chu kì 4, nhóm IIA.
B. chu kì 4, nhóm IIB.
C. chu kì 4, nhóm VIIA.
D. chu kì 4, nhóm VIIB.
Lời giải:
Đáp án D
Bài 11.7 trang 27 Sách bài tập Hóa học 10
Cho cấu hình electron của Zn là [Ar]3d104s2. Vị trí của Zn trong bảng tuần hoàn là
A. ô 29, chu kì 4, nhóm IIA.
B. ô 30, chu kì 4, nhóm IIA.
C. ô 30, chu kì 4, nhóm IIB.
D. ô 30, chu. kì 4, nhóm IIIB.
Lời giải:
Đáp án C
Bài 11.8 trang 27 Sách bài tập Hóa học 10
Các nguyên tố từ Li đến F, theo chiều tăng của điện tích hạt nhân thì
A. bán kính nguyên tử tăng, độ âm điện giảm.
B. bán kính nguyên tử và độ âm điện đều tăng.
C. bán kính nguyên tử giảm, độ âm điện tăng.
D. bán kính nguyên tử và độ âm điện đều giảm.
Lời giải:
Đáp án C
Bài 11.9 trang 28 Sách bài tập Hóa học 10
Hãy viết cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố thuộc chu kì 3.
Na (Z = 11), Mg (Z = 12), Al (Z = 13), Si (Z = 14), P (Z = 15), S (Z = 16), C1 (Z = 17).
Lời giải:
Bài 11.10 trang 28 Sách bài tập Hóa học 10
Hãy viết cấu hình electron lớp ngoài cùng của nguyên tử các nguyển tố thuộc nhóm IIA.
Be (Z = 4), Mg (Z = 12), Ca (Z = 20), Sr (Z = 38),
Ba (Z = 56), Ra (Z = 88).
Lời giải:
|
Be |
Mg |
Ca |
Sr |
Ba |
Ra |
|
2s2 |
3s2 |
4s2 |
5s2 |
6s2 |
7s2 |
Bài 11.11 trang 28 Sách bài tập Hóa học 10
Các nguyên tố thuộc các nhóm B (từ IB đến VIIIB) có mặt trong các chu kì nhỏ không ?
Lời giải:
Các nguyên tố thuộc các nhóm B (từ IB đến VIIIB) không có mặt trong các chu kì nhỏ.
Bài 11.12 trang 28 Sách bài tập Hóa học 10
Trong tự nhiên, nguyên tố bo có 2 đồng vị: 11B, nguyên tử khối coi là bằng 11, thành phần 80,1% ; 10B nguyên tử khối coi là bằng 10, thành phần 19,9%. Hãy tính nguyên tử khối trung bình của nguyên tố bo trong tự nhiên.
Lời giải:
Nguyên tử khối trung bình A của nguyên tố bo trong tự nhiên :
![]()
Nguyên tử khối trung bình của nguyên tố bo : 10,8.
Bài 11.13 trang 28 Sách bài tập Hóa học 10
Một nguyên tố X ở nhóm VIA, chu kì 3.
Hãy viết cấu hình electron nguyên tử của nguyên tố X
Hãy cho biết số thứ tự của nguyên tố X trong bảng tuần hoàn các nguyên tố hoá học.
Lời giải:
Nguyên tử X có 3 lớp electron, lớp ngoài cùng có 6 electron, vậy có cấu hình electron : 1s22s22p63s23p4
Số thứ tự bằng số proton và bằng số electron : Z = 16.
Bài 11.14 trang 28 Sách bài tập Hóa học 10
Nguyên tố X (thuộc nhóm A), có cấu hình electron lớp ngoài cùng của nguyên tử là 3s23p6
Hãy viết cấu hình electron nguyên tử (đầy đủ) của X.
Hãy cho biết số thứ tự của nguyên tố X trong bảng tuần hoàn các nguyên tố hoá học.
Lời giải:
X : 1s22s22p63s23p6
Số thứ tự bằng số proton và bằng số electron Z = 2 + 2 + 6 + 2 + 6= 18.
Bài 11.15 trang 28 Sách bài tập Hóa học 10
a) So sánh tính phi kim của Si (Z =14) với AI (Z = 13) và p (Z = 15).
b) So sánh tính phi kim của Si (Z = 14) với c (Z = 6) và Ge (Z = 32).
Lời giải:
Si có tính phi kim mạnh hơn Al, yếu hơn P.
Si có tính phi kim mạnh hơn Ge, yếu hơn C.
Bài 11.16 trang 28 Sách bài tập Hóa học 10
Cho 5,05 gam hỗn hợp hai kim loại nhóm IA và thuộc hai chu kì liên tiếp vào nước (dư), thu được 1,68 lít khí hiđro (đktc) và dung dịch B. Tìm tên hai kim loại và khối lượng chất tan có trong dung dịch B.
Lời giải:
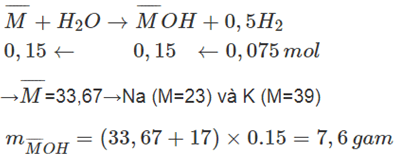
Bài 11.17 trang 28 Sách bài tập Hóa học 10
Cho 39,6 gam hỗn hợp hai muối cacbonat của hai kim loại đứng kế tiếp nhau trong nhóm IIA tác dụng hết với dung dịch HC1, thu được 6,72 lít khí CO2 (đktc). Xác định hai kim loại
Lời giải: