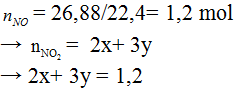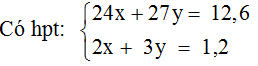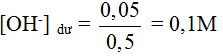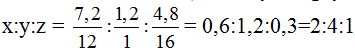Đề thi Hóa 11 Học kì 1 (đề 2)
Đề thi Hóa 11 - Học kì 1
Đề Số 2
I. TRẮC NGHIỆM (3 điểm)
Chọn đáp án đúng cho các câu sau?
Câu 1: Cho dung dịch X tác dụng với dung dịch AgNO3 tạo kết tủa màu vàng. X chứa chất tan nào sau đây?
A. NaCl B. NH4NO3 C. K3PO4 D. CuO
Câu 2:Những cặp chất nào sau đây cùng tồn tại trong một dung dịch?
A. H2SO4 và BaCl2 B. K2CO3 và CaCl2.
C. Ba(NO3)2 và NaCl. D. HCl và Ba(OH)2.
Câu 3:Dung dịch HNO3 đặc, nguội không tác dụng được với kim loại nào sau đây?
A. Ag B. Fe C. Cu D. Mg
Câu 4:Cho phản ứng nhiệt phân sau: ![]() . X là
. X là
A. Cu B. CuO C. Cu(NO2)2 D. Cu3N2
Câu 5:Hấp thụ toàn bộ 896 ml CO2 (đktc) vào 3 lít dung dịch Ca(OH)2 0,01M. Khối lượng kết tủa thu được là
A. 2 gam B. 1 gam C. 4 gam D. 3 gam
Câu 6:Hòa tan hoàn toàn 1,35 gam hỗn hợp A gồm Cu, Mg, Al bởi dung dịch HNO3 dư thì thu được 1,12 lít hỗn hợp NO và NO2 (đktc) có tỉ khối đối với H2 là 21,4. Biết không tạo muối amoni. Tổng khối lượng muối nitrat sinh ra là
A. 5,69 gam. B. 10,08 gam. C. 9,41 gam. D. 4,45 gam.
II. Phần tự luận (7 điểm)
Bài 1 (2 điểm). Hoàn thành các phương trình hóa học dưới dạng phân tử và ion rút gọn của các phản ứng xảy ra trong dung dịch giữa các cặp chất sau:
a, HNO3 + Na2CO3
b, FeCl3 + KOH
Bài 2 (2 điểm). Hòa tan hoàn toàn 12,6 gam hỗn hợp 2 kim loại Mg và Al vào dung dịch HNO3 3,0M vừa đủ. Sau phản ứng thu được 26,88 lít khí NO2 (sản phẩm khử duy nhất, ở đktc).
a,Tính khối lượng mỗi kim loại có trong hỗn hợp ban đầu.
b, Tính thể tích của dung dịch HNO3 đã dùng.
Bài 3 (1,5 điểm). Trộn 250 ml dung dịch Ba(OH)2 0,15M với 250 ml dung dịch HCl 0,1M thu được dung dịch Y. Tính pH của dung dịch Y.
Bài 4 (1,5 điểm). Đốt cháy hoàn toàn 13,2 gam chất hữu cơ B (có C, H, O) thu được 26,4 gam CO2 và 10,8 gam H2O. Biết tỉ khối hơi của B so với H2 là 44. Xác định công thức phân tử của B.
(Cho : Ba=137, Ca=40, Cu=64, Al=27, Mg=24, Na=23, H= 1, O =16, C=12, S=32, N=14)
Đáp án và thang điểm
I. TRẮC NGHIỆM (3 điểm)
Mỗi đáp án đúng được 0,5 điểm
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
|
Đáp án |
C |
C |
B |
B |
A |
A |
II. TỰ LUẬN ( 7 điểm)
Bài 1 (2 điểm).
|
Đáp án |
Biểu điểm |
|
a) 2HNO3 + Na2CO3 → 2NaNO3 + CO2 ↑+ H2O |
0,5 điểm |
|
CO32- + 2H+ → CO2 ↑+ H2O |
0,5 điểm |
|
b) FeCl3 + 3KOH → Fe(OH)3 ↓ + 3KCl |
0,5 điểm |
|
Fe3+ + 3OH- → Fe(OH)3 ↓ |
0,5 điểm |
Chú ý: Phương viết đúng, thiếu cân bằng trừ 0,25đ
Bài 2 (2 điểm).
|
Đáp án |
Biểu điểm |
|
a) Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu: |
|
|
Mg +4HNO3 → Mg(NO3)2 + 2NO2 + 2H2O (1) Al +6HNO3 → Al(NO3)3 + 3NO2 + 3H2O (2) |
0,5 điểm |
|
Gọi x, y lần lượt là số mol của Mg và Al (đk: x, y > 0). Có ∑m= 24x+27y= 12,6 |
0,25 điểm |
|
Theo pư (1) và (2) và bài ra ta có
|
0,25 điểm |
|
Giải hệ → x = 0,3; y = 0,2 |
0,25 điểm |
|
Vậy khối lượng mỗi kim loại có trong hỗn hợp ban đầu: mCu = 0,3.24 = 7,2 gam mAl = 0,2.27 = 5,4 gam |
0,25 điểm |
|
b) Tính thể tích của dung dịch HNO3 đã dùng. |
|
|
VHNO3 = 2,4/3 = 0,8 lít |
0,25 điểm 0,25 điểm |
Bài 3 (1,5 điểm).
|
Đáp án |
Biểu điểm |
|
nOH- = 2nBa(OH)2 = 0,075 mol nH+= nHCl = 0,025 mol |
0,25 điểm 0,25 điểm |
|
H+ + OH- → H2O Bđ 0,025 0,075 Pư 0,025 0,025 Sau pư 0 0,05 Vậy sau phản ứng dư bazơ |
0,5 điểm |
|
|
0,25 điểm |
|
Vậy: pH = 13,0 |
0,25 điểm |
Chú ý: HS có cách giải khác đúng vẫn cho điểm tối đa.
Bài 4 (1,5 điểm).
|
Đáp án |
Biểu điểm |
|
mC = nCO2. 12 =0,6 .12 = 7,2 g mH= nH2O. 2 = 0,6 .2 = 1,2 g mO = 13,2 -7,2 - 1,2= 4,8 g |
0,5 điểm |
|
Gọi CTĐGN là CxHyOz ( x, y, z nguyên dương) Xác định CTĐGN C2H4O |
0,5 điểm |
|
Xác định đúng công thức phân tử của X dựa vào M = 2.44= 88 g → C4H8O2 |
0,5 điểm |
Tham khảo toàn bộ: Đề kiểm tra, đề thi Hóa 11 học kì 1