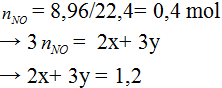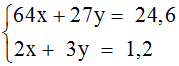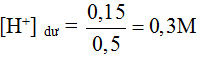Đề thi Hóa 11 Học kì 1 (đề 1)
Đề thi Hóa 11 - Học kì 1
Đề Số 1
I. TRẮC NGHIỆM (3 điểm)
Chọn đáp án đúng cho các câu sau?
Câu 1: Chất nào sau đây không tác dụng được với dung dịch HNO3 đặc, nguội?
Al B. Cu C. Zn D. Mg
Câu 2:Dung dịch X tác dụng với dung dịch NaOH tạo ra khí mùi khai. Dung dịch X là
A. dung dịch KHCO3 B. dung dịch NH4NO3
B. dung dịch Fe(NO3)3 D. dung dịch BaCl2
Câu 3:Cho phản ứng nhiệt phân sau:![]() . X là
. X là
A. MgO B. Mg C. Mg(NO2)2 D. Mg3N2
Câu 4:Những cặp chất nào sau đây cùng tồn tại trong một dung dịch?
A. H2SO4 và NaOH B. Na2CO3 và CaCl2.
C. BaCl2 và H2SO4. D. Ba(NO3)2 và KCl.
Câu 5:Hòa tan hoàn toàn 2,29 gam hỗn hợp A gồm Cu, Zn, Al bởi dung dịch HNO3 dư thì thu được 1,12 lít hỗn hợp NO và NO2 (đktc) có tỉ khối đối với H2 là 19,8. Biết không tạo muối amoni. Tổng khối lượng muối nitrat sinh ra là
A. 7,96 gam B. 5,39 gam C. 7,87 gam D. 9,11 gam
Câu 6: Hấp thụ hoàn toàn 15,68 lít CO2 (đktc) vào 250 ml dung dịch Ba(OH)2 Khối lượng kết tủa thu được là
A. 98,5 gam B. 39,4 gam C. 78,8 gam D. 59,1 gam
II, TỰ LUẬN (7 điểm)
Bài 1 (2 điểm). Hoàn thành các phương trình hóa học dưới dạng phân tử và ion rút gọn của các phản ứng xảy ra trong dung dịch giữa các cặp chất sau:
a, Na2SO4 + Ba(OH)2
b, K2CO3 + HCl
Bài 2 (2 điểm). Hòa tan hoàn toàn 24,6 gam hỗn hợp 2 kim loại Cu và Al vào 800 ml dung dịch HNO3 vừa đủ. Sau phản ứng thu được 8,96 lít khí NO (sản phẩm khử duy nhất, ở đktc).
a, Tính khối lượng mỗi kim loại có trong hỗn hợp ban đầu.
b, Tính nồng độ mol/l của dung dịch HNO3 đã dùng.
Bài 3 (1,5 điểm). Trộn 300 ml dung dịch NaOH 1,5M với 200 ml dung dịch H2SO4 1,5M thu được dung dịch X. Tính pH của dung dịch X.
Bài 4 (1,5 điểm). Đốt cháy hoàn toàn 3 gam chất hữu cơ A (có C, H, O) thu được 6,6 gam CO2 và 3,6 gam H2O. Biết tỉ khối hơi của A so với H2 là 30. Xác định công thức phân tử của A.
(Cho : Ba=137, Ca=40, Cu=64, Al=27, Mg=24, Na=23, H= 1, O =16, C=12, S=32, N=14)
Đáp án và thang điểm
I.TRẮC NGHIỆM (3 điểm)
Mỗi đáp án đúng được 0,5 điểm
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
|
Đáp án |
A |
B |
A |
D |
C |
D |
II, TỰ LUẬN ( 7 điểm)
Bài 1 (2 điểm).
|
Đáp án |
Biểu điểm |
|
a) Na2SO4 + Ba(OH)2 → BaSO4 + 2NaOH |
0,5 điểm |
|
SO42- + Ba2+ → BaSO4 |
0,5 điểm |
|
b) K2CO3 + 2HCl → 2KCl + CO2 + H2O |
0,5 điểm |
|
CO32- + 2H+ → CO2 + H2O |
0,5 điểm |
Chú ý: Phương viết đúng, thiếu cân bằng trừ 0,25đ
Bài 2 (2 điểm.)
|
Đáp án |
Biểu điểm |
|
a) Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu: |
|
|
3Cu +8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (1) Al +4HNO3 → Al(NO3)3 + NO + 2H2O (2) |
0,5 điểm |
|
Gọi x, y lần lượt là số mol của Cu và Al (đk: x, y > 0). Có ∑m= 64x+27y= 24,6 |
0,25 điểm |
|
Theo pư (1) và (2) và bài ra ta có
|
0,25 điểm |
|
Có hpt: Giải hệ → x = 0,3; y = 0,2 |
0,25 điểm |
|
Vậy khối lượng mỗi kim loại có trong hỗn hợp ban đầu: mCu = 0,3.64 = 19,2 gam mAl = 0,2.27 = 5,4 gam |
0,25 điểm |
|
b) Tính nồng độ mol/l của dung dịch HNO3 đã dùng. |
|
|
CM HNO3 = 1,6/0,8 = 2M |
0,25 điểm 0,25 điểm |
Chú ý: HS có cách giải khác đúng vẫn cho điểm tối đa.
Bài 3 (1,5 điểm)
|
Đáp án |
Biểu điểm |
|
nOH- = nNaOH = 0,45 mol nH+= 2nH2SO4 = 0,6 mol |
0,5 điểm |
|
H+ + OH- → H2O Bđ 0,6 0,45 Pư 0,45 0,45 Sau pư 0,15 0 Vậy sau phản ứng dư axit |
0,5 điểm |
|
|
0,25 điểm |
|
Vậy: pH = 0,52 |
0,25 điểm |
Chú ý: HS có cách giải khác đúng vẫn cho điểm tối đa.
Bài 4 (1,5 điểm).
|
Đáp án |
Biểu điểm |
|
mC = nCO2. 12 =0,15 .12 = 1,8 g mH= nH2O. 2 = 0,2 .2 = 0,4 g mO = 3 -1,8 - 0,4= 0,8 g |
0,5 điểm |
|
Gọi CTĐGN là CxHyOz ( x, y, z nguyên dương)
Xác định CTĐGN C3H8O |
0,5 điểm |
|
Xác định đúng công thức phân tử của X dựa vào M = 2.30= 60 g → C3H8O |
0,5 điểm |
Tham khảo toàn bộ: Đề kiểm tra, đề thi Hóa 11 học kì 1