Đề kiểm tra 1 tiết Hóa 12 Chương 7 - Đề 11
Đề kiểm tra 1 tiết Hóa 12 Chương 7 - Đề 11
ĐỀ BÀI
MỨC ĐỘ BIẾT (7 CÂU)
Câu 1: Sắt không tan được trong dung dịch
A. HCl đặc, nguội.
B. H2SO4 đặc, nguội.
C. HNO3 đặc, nóng.
D. HNO3 loãng, nguội.
Câu 2: Muốn khử ion Fe3+ trong dung dịch thành ion Fe2+, ta phải thêm một lượng dư kim loại
A. Zn
B. Na.
C. Cu.
D. Ag.
Câu 3: Hợp chất của Fe vừa thể hiện tính khử, vừa thể hiện tính oxi hóa là
A. FeO
B. Fe2O3.
C. FeCl3.
D. Fe(NO3)3.
Câu 4: Phản ứng tạo xỉ trong lò cao là
A. CaCO3 → CaO + CO2.
B. CaO + SiO2 → CaSiO3.
C. CaO + CO2 → CaCO3.
D. CaSiO3 → CaO + SiO2.
Câu 5: Crom là kim loại
A. có tính khử mạnh hơn sắt.
B. chỉ tạo được oxit bazơ.
C. có tính lưỡng tính.
D. có độ cứng thấp.
Câu 6: Hai chất đều có tính lưỡng tính là
A. CrO, Al2O3.
B. CrO, CrO3.
C. Cr2O3, Al2O3.
D. Al2O3, CrO3.
Câu 7: Phát biểu nào dưới đây không đúng?
A. Fe(OH)2 và Cr(OH)2 đều là bazơ.
B. Al(OH)3 và Cr(OH)3 đều là chất có tính lưỡng tính.
C. Dung dịch chứa hỗn hợp H2SO4 và K2Cr2O7 oxi hóa được FeSO4.
D. Crom không phản ứng với dung dịch H2SO4 loãng.
MỨC ĐỘ HIỂU (7 CÂU)
Câu 8: Sắt phản ứng với dung dịch nào sau đây tạo được hợp chất trong đó sắt có hóa trị (III)?
A. H2SO4 loãng.
B. CuSO4.
C. HCl đậm đặc.
D. HNO3 loãng.
Câu 9: Sơ đồ chuyển hoá: ![]() (mỗi mũi tên là một phản ứng). X, Y lần lượt là
(mỗi mũi tên là một phản ứng). X, Y lần lượt là
A. HCl, NaOH.
B. HCl, Al(OH)3.
C. NaCl, Cu(OH)2.
D. Cl2,NaOH.
Câu 10: Nhận định nào sau đây không đúng?
A. Phần trăm khối lượng cacbon trong gang nhiều hơn thép.
B. Nguyên liệu để luyện ra thép là gang.
C. Chất khử dùng để luyện gang là cacbon monooxit.
D. Các loại thép đều không phản ứng với các dung dịch axit.
Câu 11: Cấu hình electron của ion Cr2+ là
A. [Ar]3d4.
B. [Ar]3d5.
C. [Ar]3d3.
D. [Ar]3d54s1.
Câu 12: Phương trình hoá học nào sau đây không đúng?
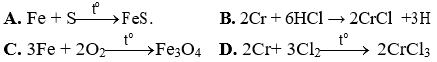
Câu 13: Phản ứng sau đây xảy ra ở 25oC: Zn + 2Cr3+ → Zn2+ + 2Cr2+. Nhận định đúng là
A. Zn có tính khử mạnh hơn Cr2+ và Cr3+ có tính oxi hoá mạnh hơn Zn2+.
B. Zn có tính khử yếu hơn Cr2+ và Cr3+ có tính oxi hoá yếu hơn Zn2+.
C. Zn có tính oxi hoá mạnh hơn Cr2+ và Cr3+ có tính khử mạnh hơn Zn2+.
D. Zn có tính oxi hoá yếu hơn Cr2+ và Cr3+ có tính khử yếu hơn Zn2+.
Câu 14: Hiện tượng xảy ra khi nhỏ vài giọt dung dịch H2SO4 vào dung dịch Na2CrO4 là màu của dung dịch chuyển từ
A. vàng sang không màu.
B. da cam sang vàng.
C. vàng sang da cam.
D. không màu sang da cam.
MỨC ĐỘ VẬN DỤNG (8 CÂU)
Câu 15: Cho 2,52 gam một kim loại R tác dụng với dung dịch H2SO4 loãng tạo ra 6,84 gam muối sunfat. R là (O=16, S=32, Fe=56, Cr=52, Mg=24, Mn=55)
A. Mg.
B. Fe.
C. Cr.
D. Mn.
Câu 16: Hòa tan m gam hỗn hợp Al và Fe trong lượng dư dung dịch H2SO4 loãng thoát ra 0,4 mol khí, còn trong lượng dư dung dịch NaOH thì thu được 0,3 mol khí. Giá trị của m là (Fe=56, Al=27)
A. 11,0.
B. 12,28.
C. 13,7.
D. 19,5.
Câu 17: Để khử hoàn toàn 32 gam hỗn hợp CuO, FeO, Fe2O3, Fe3O4, MgO cần dùng 5,6 lít khí CO (ở đktc). Khối lượng chất rắn sau phản ứng là (O=16, C=12, Fe=56, Cr=52, Cu=64)
A. 28 gam.
B. 26 gam.
C. 22 gam.
D. 24 gam.
Câu 18: Muốn điều chế 6,72 lít khí clo (đktc) thì khối luợng K2Cr2O7 tối thiểu cần dùng để tác dụng với dung dịch HCl đặc, dư là (O=16, K=39, Cr=52)
A. 29,4 gam.
B. 27,4
C. 28,4 gam.
D. 26,4 gam.
Câu 19: Cho 18,9 gam hỗn hợp X gồm Cr(OH)2 và Cr(OH)3 tác dụng hoàn toàn với dung dịch NaOH dư thu được chất rắn Y. Để hòa tan Y cần vừa đủ 100 ml dung dịch H2SO4 1M. Thành phần phần trăm khối lượng Cr(OH)3 trong X là (O=16, H=1, Cr=52)
A. 27,25%.
B. 72,75%.
C. 54,5%.
D. 45,5%.
Câu 20: Tiến hành thí nghiệm theo thứ tự sau:
- Cho vào ống nghiệm 20 ml dung dịch FeSO4, sau đó cho thêm vài giọt dung dịch H2SO4 loãng.
- Tiếp tục nhỏ vào ống nghiệm trên 5ml dung dịch KMnO4 loãng. Quan sát thấy hiện tượng
A. mất màu nâu đỏ của dung dịch FeSO4.
B. có kết tủa nâu đỏ.
C. dung dịch sau phản ứng có màu xanh.
D. mất màu tím của dung dịch KMnO4.
Câu 21: Khi cho 100 gam hợp kim gồm có Fe, Cr và Al tác dụng với dung dịch NaOH loãng dư thu được 6,72 lít khí. Lấy phần không tan cho tác dụng với dung dịch HCl dư (không có không khí) thu được 38,08 lít khí. Các phản ứng xảy ra hoàn toàn và thể tích khí đo ở đktc. Phần trăm khối lượng của Cr trong hợp kim là (O=16, Cl=35.5, Al=27, Fe=56, Cu=64)
A. 7,8%.
B. 12, 9%.
C. 33,7%.
D. 29,5%.
Câu 22: Cho 2,24 gam bột sắt vào 200 ml dung dịch chứa hỗn hợp gồm AgNO3 0,1M và Cu(NO3)2 0,5M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là (O=16, N=14, Ag=108, Fe=56, Cu=64)
A. 2,80.
B. 2,16.
C. 4,08.
D. 0,64.
MỨC ĐỘ VẬN DỤNG CAO (3 CÂU)
Câu 23: Hòa tan hoàn toàn 58 gam hỗn hợp X gồm Fe, Cu, Ag trong dung dịch HNO3 dư thu được 0,15 mol NO, 0,05 mol N2O (không có sản phẩm khử khác) và dung dịch Y. Khối lượng muối khan thu được khi cô cạn Y là (O=16, N=14, Ag=108, Fe=56, Cu=64)
A. 110,7 gam.
B. 89,8
C. 116,9 gam.
D. 90,3 gam.
Câu 24: Cho 100 ml dung dịch AgNO3 2a mol/l vào 100 ml dung dịch Fe(NO3)2 a mol/l. Sau khi phản ứng kết thúc thu được 8,64 gam chất rắn và dung dịch X. Cho dung dịch HCl dư vào X thu được m gam kết tủa. Giá trị của m là (O=16, Fe=56, Cl=35,5, Ag=108)
A. 22,96.
B. 11,48.
C. 17,22.
D. 14,35.
Câu 25: Nung hỗn hợp bột gồm 15,2 gam Cr2O3 và m gam Al ở nhiệt độ cao. Sau khi phản ứng hoàn toàn, thu được 23,3 gam hỗn hợp rắn X. Cho toàn bộ X vào dung dịch HCl (dư) thoát ra V lít khí H2 (đktc). Giá trị của V là (O=16, Al=27, Cr=52)
A. 7,84.
B. 4,48.
C. 3,36.
D. 10,08.
ĐÁP ÁN
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
B |
C |
A |
B |
A |
C |
D |
D |
D |
D |
A |
B |
A |
|
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
|
C |
B |
A |
A |
A |
C |
D |
A |
C |
A |
B |
A |
|
